由下列反应得出的结论中正确的是
A.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O还原性由强到弱:HCl(浓)>MnCl2 MnCl2+Cl2↑+2H2O还原性由强到弱:HCl(浓)>MnCl2 |
| B.H2S + CuSO4 =" CuS↓+" H2SO4酸性由强到弱:H2S>H2SO4 |
| C.2KClO3+I2=2KIO3+Cl2非金属性由强到弱:I>Cl |
| D.NaAlO2 + NaHCO3 + H2O = Al(OH)3 ↓+ Na2CO3电离由易到难:Al(OH)3>HCO3- |
下列物质一定属于同系物的是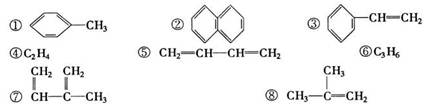
| A.④和⑧⑤和⑦ | B.①、②和③ | C.④、⑥ | D.④、⑥和⑧ |
下列烷烃中,进行一氯取代反应后,只能生成三种沸点不同产物的是
A (CH3)2CHCH(CH3)2 B (CH3CH2)2CHCH3
C (CH3)2CHCH2C(CH3)3 D (CH3)3CCH2CH3
下列关于甲苯的实验中,能说明侧链对苯环有影响的是
| A.甲苯硝化生成三硝基甲苯 |
| B.甲苯能使酸性高锰酸钾溶液褪色 |
| C.甲苯燃烧带有浓厚的黑烟 |
| D.甲苯与氢气可以生加成反应 |
下列物质在光照条件下,可与C2H6发生化学反应的是
| A.Cl2 | B.O2 | C.溴水 | D.酸性KMnO4溶液 |
下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是
| A.乙烷与氯气混合 | B.乙烯与氯化氢气体混合 |
| C.乙烯与氯气混合 | D.乙烯通入浓盐酸 |