下列有关溶液性质的叙述,正确的是
| A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体 |
| B.20℃,100g水可溶解34.2g KCl,此时KCl 饱和溶液的质量分数为34.2% |
| C.强电解质在水中溶解度一定大于弱电解质 |
| D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加 |
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )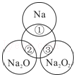
| A.Na2O2中阴阳离子数目之比为1:1 |
| B.反应①的离子方程式为:Na+2H2O=Na++2OH﹣+H2↑ |
| C.反应③最多能产生0.05mol O2 |
| D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
将SO2通入一定量NaOH溶液中,充分反应后,该溶液溶质组成不可能为( )
| A.Na2SO3和NaOH | B.NaHSO3 |
| C.NaHSO3和Na2SO3 | D.NaOH和NaHSO3 |
NA表示阿伏加德罗常数.下列说法中正确的是( )
| A.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA |
| B.1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
| C.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA |
| D.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族;X+与M2—具有相同的电子层结构;离子半径:Z2—>W—;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
已知下列热化学方程式,则③中的Q3值为
Zn(s)+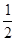 O2(g)=ZnO (s)△H=" -" Q1 kJ• mol-1①
O2(g)=ZnO (s)△H=" -" Q1 kJ• mol-1①
Hg(l) +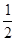 O2(g)=HgO (s)△H= -Q2 kJ• mol-1②
O2(g)=HgO (s)△H= -Q2 kJ• mol-1②
Zn(s) +HgO (s) =Hg(l)+ ZnO (s)△H= -Q3 kJ• mol-1③
| A.Q2 -Q1 | B.Q1 +Q2 | C.Q1- Q2 | D.-Q1- Q2 |