由乙烯和其它无机原料合成环状酯E和高分子化合物H的示意图如下:
请回答下列问题:
(1)写出结构简式:A F C
(2)反应类型:X 、Y
(3)写出化学反应方程式:
A→B
G→H
(4)若环状酯E在NaOH溶液中共热,则发生反应的化学方程式为:
二氧化碳又名碳酸气,具有较高的民用和工业价值,在多种领域有着广泛的应用。目前,二氧化碳在棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等也展现良好的发展前景。二氧化碳是一种无色无味的气体,无毒、不导电并且没有可燃性。但是金属镁在点燃的条件下可以在二氧化碳气体中燃烧。其中还原产物是碳
Ⅰ.①氧化产物是
②请写出化学反应方程式,并用单线桥法表示该反应的电子转移总数
Ⅱ.CO2气体与碱溶液反应时,用量不同其生成的产物不同。
①少量CO2通入过量的KOH溶液中,请写出离子反应方程式
②取两份等物质的量浓度等体积的Ca(OH)2的溶液,一份通入过量CO2,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图所示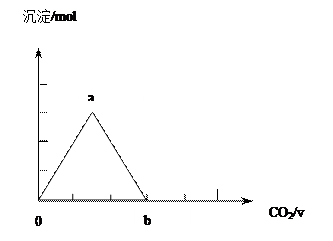

写出沉淀变化由a到b的离子方程式:
Ⅲ.另一份先加入少量的KOH固体溶解,再将过量CO2通入KOH和Ca(OH)2的混合溶液中,请绘图表示出生成沉淀的物质的量(n)和通入CO2体积(V)的关系;并写出与图②中不同曲线处对应的离子反应方程式
有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学 式是__________。
式是__________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的 离子方程式是_______________。
离子方程式是_______________。
此液体具有的性质是__________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为__________。
②原无色有刺激性气味的气体与含1.5mol Y的一种含氧 酸(该酸的
酸(该酸的 某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________
某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________ _________。
_________。
有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学 式是__________。
式是__________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的 离子方程式是_______________。
离子方程式是_______________。
此液体具有的性质是__________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为__________。
②原无色有刺激性气味的气体与含1.5mol Y的一种含氧 酸(该酸的
酸(该酸的 某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________
某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________ _________。
_________。
有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学 式是__________。
式是__________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的 离子方程式是_______________。
离子方程式是_______________。
此液体具有的性质是__________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为__________。
②原无色有刺激性气味的气体与含1.5mol Y的一种含氧 酸(该酸的
酸(该酸的 某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________
某盐常用于实验室制取氧气)的溶液在一定条件下反应.可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________ _________。
_________。
请认真阅读下列三个反应:
利用这些反应,按以下步骤可从某烃A合成一种染料中间体DSD酸:
请写出A、B、C、D的结构简式。