T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
某链状有机物分子中含有n个—CH2—,m个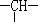 ,a个—CH3,其余为—OH,则羟基的个数为 ( )
,a个—CH3,其余为—OH,则羟基的个数为 ( )
| A.2n+3m-a | B.m+2-a | C.n+m+a | D.m+2n+2-a |
现在大量盆栽鲜花都施用了S诱抗素制剂,以保持鲜花盛开。S诱抗素的分子结构如图,下列关于该分子说法正确的是 ( )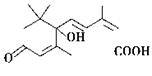
| A.含有碳碳双键、羟基、羰基、羧基 |
| B.含有苯环、羟基、羰基、羧基 |
| C.含有羟基、羰基、羧基、酯基 |
| D.含有碳碳双键、苯环、羟基、羰基 |
某有机物的分子式为C5 H4ClF3,就其结构来说,该有机物不可能是 ( )
| A.含两个双键的链状化合物 | B.含一个双键的环状化合物 |
| C.含一个三键的链状化合物 | D.只含—个双键的链状化合物 |
为了减少大气污染,许多城市推广清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气。这两类燃料的主机成分是()
| A.碳水化合物 | B.碳氢化合物 | C.氢气 | D.醇类 |
下列物质一定与丁烯互为同系物的是()
| A.C2H4 | B.C3H6 | C.C4H8 | D.C4H10 |