(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ —_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,
多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步中离子方程式。
(2)计算工业甲醇的质量分数。
在密闭容器中,将2.0 mol CO与10mol H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g) 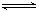 CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol•L-1,c(H2O)=6.0mol•L-1,c(CO2)=3.0mol•L-1,c(H2)= 4.5mol•L-1,则此时该反应向_________方向移动。
CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol•L-1,c(H2O)=6.0mol•L-1,c(CO2)=3.0mol•L-1,c(H2)= 4.5mol•L-1,则此时该反应向_________方向移动。
在标准状况下,将224L HCl气体溶于635mL水(ρ=1.00g·cm-3)中,所得盐酸的密度为1.18g·cm-3。此溶液物质的量浓度应该为多少?若取出这种盐酸10.0mL,向其中加水配制成1L溶液,则所得稀盐酸的物质的量浓度应该为多少?
(共9分,每小题3分)常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
①该溶液中阴阳离子的总物质的量②该溶液中CuSO4的物质的量浓度
③取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?(计算过程规范)
100mL 0.1 mol·L-1HCI与等体积0.15 mol·L-1 Ba(OH)2溶液混合,求PH值(写出过程)。
在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.008mol/L.
(1) 求该反应的平衡常数.
(2) 在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到平衡状态时 C(H2)、C(I2)、C(HI)