氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
| A.由反应可确定:氧化性HClO3>O2 |
| B.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| C.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为: 3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
用惰性电极电解2L饱和氯化钠溶液,经过一段时间以后,电解液的pH上升至13
(Kw=10-14),则电解过程中两极上共产生的气体在标准状况下体积为
| A.2.24L | B.4.48L | C.1.12L | D.11.2L |
夏天,鸡没有汗腺只能依赖“喘息”调节体温。鸡过度的呼出CO2,使下列平衡向左移动导致蛋壳变薄,使农场主和超市经营者蒙受经济损失。CO2(g) 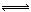 CO2(aq),CO2(aq)+H2O
CO2(aq),CO2(aq)+H2O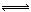 H2CO3(aq),H2CO3(aq)
H2CO3(aq),H2CO3(aq)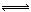 H+(aq)+HCO3-(aq),HCO3—(aq)
H+(aq)+HCO3-(aq),HCO3—(aq) 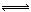 H+(aq)+CO32-(aq),Ca2+(aq)+CO32-(aq)
H+(aq)+CO32-(aq),Ca2+(aq)+CO32-(aq)  CaCO3(s)(蛋壳)澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料是
CaCO3(s)(蛋壳)澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料是
| A.淡盐水 | B.碳酸水 | C.碳酸钠溶液 | D.澄清石灰水 |
用惰性电极电解下列溶液一段时间后,加入一定量的另一种物质(括号内),溶液能与原来溶液完全一样的是
| A.CuSO4(Cu(OH)2) | B.NaOH(NaOH) | C.NaCl(H2O) | D.CuCl2(CuCl2) |
下图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是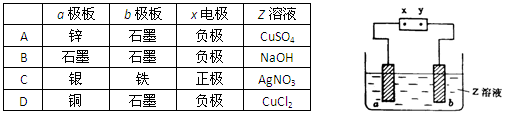
出现于20世纪50年代的镍(Ni)镉(Cd)电池是一种可充电碱性电池,至今仍占有很大的市场份额,但由于镉是致癌物质,故镍镉电池有逐渐被其它可充电电池取代的趋势。镍镉电池以氢氧化钾为电解质溶液,电池在充、放电时的工作原理为:
Cd(s) + 2 NiOOH(s)+2 H2O(l) Cd(OH)2(s) + 2 Ni(OH)2(s)
Cd(OH)2(s) + 2 Ni(OH)2(s)
下列关于镍电池的说法错误的是
| A.电池工作时的负极反应是:Cd(s) - 2e-+2OH-(aq)=Cd(OH)2(s) |
| B.充电时的阳极反应是:Ni(OH)2(s) - e-+OH-(aq)=NiOOH(s)+H2O(l) |
| C.放电时每转移1mol电子,正极有1 mol NiOOH被还原 |
| D.电池工作时,负极区pH增大,正极区pH减小,但整个电池的pH基本保持不变 |