为使食品在较长的时间内保持色、香、味和口感,人们常在食品或食品包装中加入化学防腐剂.请根据图回答:
(1)苯甲酸中C、H、O元素的原子个数比为 ,C、H元素的质量比为 ,相对分子质量为 。
(2) g苯甲酸中含有6.4g氧元素。
科学兴趣小组同学在综合实践活动中了解到,某石灰厂有一批石灰石原料,其中含有的杂质二氧化硅(二氧化硅不溶于水,不能与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.
| 稀盐酸的用量 |
剩余固体的质量 |
| 第一次加入5克 |
1.5克 |
| 第二次加入5克 |
克 |
| 第三次加入5克 |
0.5克 |
| 第四次加入5克 |
0.3克 |

计算:
(1)分析上述图与表,第二次加入稀盐酸后,剩余固体的质量是 克;
(2)该石灰石样品中碳酸钙的质量分数;
(3)所用稀盐酸中溶质的质量分数是多少?
如图是稀盐酸和氢氧化钠溶液,其中一种物质逐滴加入另一种物质过程中溶液酸碱度的变化情况.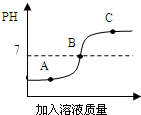
(1)该实验操作是将 滴加到另一种溶液中.
(2)图中 点时溶液中酸和碱恰好完全反应.
(3)若要将36.5克10%的盐酸全部反应完,需要NaOH多少克?(HCl+NaOH═NaCl+H2O)
维生素C(C6H8O6)主要存在于蔬菜,水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.计算:
(1)维生素C的相对分子质量 .
(2)维生素C中碳、氢两种元素的质量比 (写最简比).
(3)维生素C中 元素的质量分数最大.
精盐(NaCl)和纯碱(Na2CO3)是两种常见之物.
(1)用化学方法区别这两种固体,可以选择下列哪一种物质?
| A.白酒 | B.米醋 | C.纯净水 | D.酱油 |
(2)王军同学不慎在精盐中混入了少量纯碱,他想重新得到精盐,设计了以下两个实验方案:
方案一:固体混合物 溶液
溶液 固体
固体
方案二:固体混合物 溶液
溶液 固体
固体
你认为合理的实验方案是 .
说明另一方案不合理的理由: .
(3)假设(2)中固体混合物有53克,加入足量的稀酸充分反应后,生成4.4克,二氧化碳气体,求该固体混合物中氯化钠的质量分数.
火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:
2CaCO3(粉末)+2SO2 + O2 ="==" 2CaSO4+2CO2.
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)80%的石灰石 克;
(2)处理上述100克废气,可得到含CaSO4 85%的粗产品多少克?(请写出计算过程)