下表是元素周期表的一部分:
| 族 周期 |
IA |
|
0 |
|||||
| 一 |
1 H 1.008 |
ⅡA |
ⅢA |
ⅣA |
V A |
ⅥA |
ⅦA |
2 He 4.003 |
| 二 |
3 Li 6.941 |
4 Be 9.012 |
5 B 10.81 |
6 C 12.01 |
7 N 14.01 |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
| 三 |
11 Na 22.99 |
12 Mg 24.31 |
13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.06 |
17 Cl 35.45 |
18 Ar 39.95 |
(1)Ne元素的原子核电荷数为_______,形成单质的化学式是 。
(2)某元素的原子结构示意图如右,则X的值为 。该元素与17号元素形成的化合物的化学式是 ,化合物中阴离子的结构示意图是 。
(3)请用表中的元素符号所组成的反应物写出符合要求的化学方程式:有水生成的化合反应:________________________________________。
(1)用微粒的观点解释:"酒城处处飘酒香"现象的原因为.
(2)自然界消耗二氧化碳的主要途径是植物的作用.
(3)葡萄糖(
)在人体内经缓慢氧化转变为二氧化碳和水,提供人体所需的能量,该反应的化学方程式为.
(1)某简单粒子的结构示意图可表示为: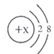
当
时,该粒子符号为;当
时,该粒子符号为;当
时,写出该粒子的硫酸盐的化学式为:;
(2)
时,将5.2
固体溶于20.0
水中,刚好形成饱和溶液.
时,
的溶解度为.
(3)久置在空气中的氢氧化钠溶液,会生成一种盐类杂质,向其中加入稀盐酸时会产生无色气体.生成这种杂质的化学方程式为:;向氢氧化钠溶液中滴入几滴酚酞试剂,溶液会变.
(4)"孔雀石"的主要成分是碱式碳酸铜[
],它是一种重要的铜矿石原料,受热可分解为三种常见的化合物,物质转化关系如图,其中A是最常见的液态物质,B是黑色固体,F、G为金属单质.根据推断回答下列问题: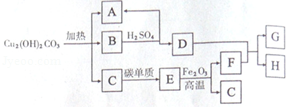
①H的化学式是;
②碱式碳酸铜[
]中铜元素与氧元素的质量之比为:;
③写出D+F→G+H反应的化学方程式:;
④向
]中加入足量的盐酸,固体完全溶解,有无色气体生成,写出此反应的化学方程式:.
材料的发展和应用,推动了社会的进步.铁、铜、棉花、聚乙烯塑料中人们生活和生产中常见的材料.
①上述材料中,属于天然有机高分子的是.
②铁是世界上使用最广的金属,工业上炼铁是利用一氧化碳的还原性把铁从铁的矿石中还原出来.请写出一氧化碳和氧化铁在高炉中的化学反应方程式.
③为了探究铁和铜的金属活动性强弱,完成该实验有多种方案,写出其中一种方案中涉及的化学反应方程式.
硬水中含有较多可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦.
①硬水可用来区分,生活中可用来降低水的硬度.
②硬水在加热或久置时,会产生水垢[主要成分是
],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式:、
。
如图为a、b、c三种物质(均不含结晶水)的溶解度曲线,据图回答下列问题.
①
时,50
水中最多可溶解a物质
② 时,a、b、c三种物质溶解度由大到小的顺序是(填写物质序号)
③将 时a、b、c三种物质的饱和溶液升温至 时,三种溶液的溶质质量分数大小是(填写物质序号).
