某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同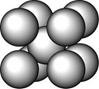

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)右上图的的堆积方式为 ,经测定其结构和性质参数如下表所示
| 金属 |
相对原子质量 |
分区 |
密度/g·㎝-3 |
原子化热/kJ·mol-1 |
| Na |
22.99 |
s区 |
0.960 |
108.4 |
| A |
60.20 |
d区 |
7.407 |
7735 |
则A原子的原子半径为 pm,试解释该晶体原子化热很高的原因
。
(已知 ,7.407≈
,7.407≈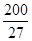 ,1pm=10
,1pm=10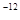 m)
m)
标准状况下,1.68L无色无味的可燃性气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水.得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)计算燃烧产物中水的质量:_______________
(2)若原气体是单一的烃类气体,通过计算推断它的化学式:______________________
(3)若原气体是两种等物质的量的气态烃的混合物,请写出它们的结构简式(要求写出两组符合条件的物质的结构简式):______和______、________和_______
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X元素的最外层电子数是次外层电子数的三倍。
(1)写出实验室制取W2的离子方程式;
(2)某小组设计如图所示的实验装置图(图中夹持和加热装置略去),分别研究YX2和W2 的性质。
①分别通入YX2和W2 时,在装置A中观察到的现象是否相同(填“相同”或“不相同”)。
装置D中装的是五氧化二钒,当通入YX2时,打开K放入适量的氧气,在D装置中发生化学反应方程式为,
②若装置B中装有5.0 mL 1.0×10-3 mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5 mol电子,该反应的化学方程式为。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入适量(填字母),可以看到白色沉淀产生。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
现有A、B、C、D、E五种烃,作如下实验:
(1)各取0.01mol上述五种烃,分别使之充分燃烧,其中B、C、E燃烧所得的CO2均为448mL(标况)。A、D燃烧所得的CO2都是B、C、E的三倍。
(2)在适当的条件下,A、B、C都能跟氢气发生加成反应。其中A可直接转变为D,B可转变为c或E,C可转变为E
(3)B和c都能使溴水或酸性高锰酸钾溶液褪色,而A、D、E则无此性质。
(4)用铁屑作催化剂时,A可与液态溴发生取代反应。请判断后填写下表:
| A |
B |
C |
D |
E |
|
| 结构简式 |
(10分)甲、乙、丙、丁是四种短周期元素,它们的原子序数依次增大,其中甲和丙、乙和丁分别是同主族元素,又知乙、丁两元素的原子核中质子数之和是甲、丙两元素原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。
(1)写出甲、乙、丙三种元素组成的化合物的电子式________,指出其中含有的化学键的类型_______、_______。
(2)写出乙与丙按原子个数比1:1组成的化合物与水反应的化学方程式_________。
(3)用甲元素的单质与乙元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特质的防止透过的隔膜,在A极通入甲的单质,B极通入乙的单质,则A极是该电池的_______极,B极的电极反应式是 ___________
(10分)分子中只含有2个碳原子的某烃A是其同系物中含碳量最高的物质; 1mol A与1mol HCl加成可得到B;1mol A与1mol H2加成可得到C,并能继续发生如下列图表所示的转变:</PGN0306.TXT/PGN>
据此回答下列问题
(1)写出C制取D的反应方程式 ___ _ ____________ __;
(2)以B为原料经过加聚反应所得的合成树脂的结构简式为__ __。
(3)写出由D和F生成G的反应方程式:
________________________
(4)写出E与银氨溶液反应的化学方程式:
___________ ____ __ ____
(5)写出符合以下两个条件的G的同分异构体,①能水解②能发生银镜反应: