在高温下,反应2HBr(g)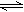 H2(g) + Br2(g)(△H>0)达到平衡时,要使混合气体的颜色变浅,且使Br2的百分含量保持不变,可采取的方法是()
H2(g) + Br2(g)(△H>0)达到平衡时,要使混合气体的颜色变浅,且使Br2的百分含量保持不变,可采取的方法是()
| A.增大体积 | B.增大压强 |
| C.降低温度 | D.保持体积不变增加氢气 |
在一密闭容器中,反应aA(g)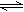 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来平衡时的60%,则下列说法不正确的是()
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来平衡时的60%,则下列说法不正确的是()
| A.平衡向正反应方向移动了 | B.物质A的转化率增大了 |
| C.物质B的质量分数增加了 | D.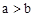 |
在体积固定的密闭容器中通入各为1mol的A、C、D和x mol B,发生反应:A(g)+4B(g)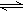 2C(g)+D(g)。当x在一定范围内变化时,均可以通过调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol。若使起始反应向正反应方向进行,则x的取值范围下列适合的是()
2C(g)+D(g)。当x在一定范围内变化时,均可以通过调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol。若使起始反应向正反应方向进行,则x的取值范围下列适合的是()
A. 1<x<2 B. 2<x<4 C. 1<x<5 D. 2<x<5
在可逆反应:X(g)+2Y(g)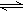 2Z(g)(△H>0),为了有利于Z的生成,应采用的反应条件是()
2Z(g)(△H>0),为了有利于Z的生成,应采用的反应条件是()
| A.高温高压 | B.高温低压 | C.低温高压 | D.低温低压 |
在密闭容器中进行反应:X2(g)+Y2(g)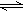 2Z(g)。已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L 、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是()
2Z(g)。已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L 、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是()
| A.Z为0.3mol/L | B.Y2为0.35mol/L |
| C.X2为0.15mol/L | D.Z为0.4mol/L |