(10分)(2011·锦州高一检测)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下: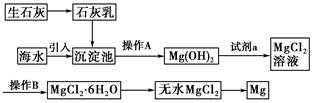
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池发生反应的离子方程式 ________________________________________________________.
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________________________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为______________________________________________________________________。
从考虑成本和废物循环利用的角度,副产物氯气可以用于
__________________________________________________________________。
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。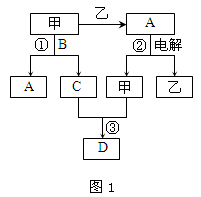

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有(填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是。
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是(填字母)。
A升高温度 B降低温度 C增大压强
D减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为mol•L-1•min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 |
n(甲) |
n(C) |
n (D) |
v正与v逆的关系 |
| Ⅰ |
0.20 |
0.10 |
0.20 |
v正=v逆 |
| Ⅱ |
0.20 |
0.40 |
1.00 |
②? |
| Ⅲ |
0.60 |
1.20 |
0.80 |
③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格:②③
(14分)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g)△H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g)△H=—256.1kJ·mol—1。
已知:H2O(l)=H2O(g)△H=+44kJ·mol—1
CO(g)+H2O(g) CO2(g)+H2(g)△H=—41.2kJ·mol—1
CO2(g)+H2(g)△H=—41.2kJ·mol—1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(l)△H=。
CH3CH2OH(g)+3H2O(l)△H=。
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ |
800 |
1000 |
1200 |
1400 |
| 平衡常数 |
0.45 |
1.92 |
276.5 |
1771.5 |
①该反应是_____反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol·L—1,该温度下反应CH4+H2O CO+3H2的平衡常数K=。
CO+3H2的平衡常数K=。
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图。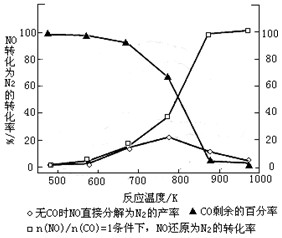
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出CH4与NO2发生反应的化学方程式:。
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2—离子。该电池负极的电极反应式为。
(12分)某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:
(1)放电时,正极的电极反应式为;充电时,Pb电极应该连接在外接电源的(填“正极”或“负极”)。
(2)工业用PbO2来制备KClO4的工业流程如下: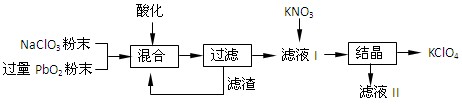
①写出NaClO3与PbO2反应的离子方程式:。
②工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是。
(3)PbO2会随温度升高逐步分解,称取23.9gPbO2,其受热分解过程中各物质的质量随温度的变化如右图所示。
若在某温度下测得剩余固体的质量为22.94g,则该温度下PbO2分解所得固体产物的组成为(写化学式),其物质的量之比为。
(15分)有机物G是一种食品香料,其香气强度为普通香料的3~4倍,有机物I的合成路线如下: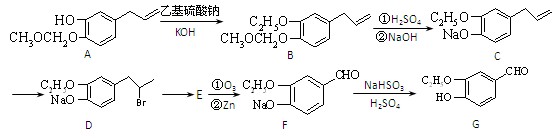
已知: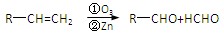
(1)该香料长期暴露于空气中易变质,其原因是。
(2)写出A中含氧官能团的名称:,由C到 D的反应类型为。
(3)有机物E的结构简式为。
(4)有机物G同时满足下列条件的同分异构体有种。
①与FeCl3溶液反应显紫色;
②可发生水解反应,其中一种水解产物能发生银镜反应;
③分子中有4种不同化学环境的氢。
(5)写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中A的相对分子质量通过质谱法测得为56,它的核磁共振氢谱显示只有三组峰;D可以发生银镜反应,在催化剂存在条件下1 mol D与2 mol H2反应可以生成乙;丙中含有两个-CH3

(1)A的结构简式为;乙的分子式为。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(3)D所含官能团的名称是;D有多种同分异构体,其中与其所含官能团相同的同分异构体有种(不考虑立体异构)。
(4)甲与乙反应的化学方程式为。
(5)写出满足下列条件的有机物的结构简式ⅰ与乙互为同分异构体;ⅱ遇FeCl3溶液显紫色;ⅲ其苯环上的一溴代物只有两种。