相同质量的Na、Mg、Al分别与过量的盐酸反应,在相同条件下置换出H2的体积比是
| A.36∶69∶92 | B.23∶12∶9 | C.1∶2∶3 | D.9∶12∶23 |
要检验某溴乙烷中的溴元素,正确的实验方法是
| A.加入溴水振荡,观察水层是否有棕红色出现 |
| B.滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 |
| C.加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
| D.加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
以下实验能获得成功的是
| A.用酸性KMnO4溶液鉴别乙烯和丙烯 |
| B.将铁屑、溴水、苯混合制溴苯 |
| C.苯和硝基苯的混合物采用分液的方法分离 |
| D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
下面关于甲醛的几种说法中,正确的是
| A.它在常温、常压下是一种无色有刺激性气味的液体 |
| B.现代装修房子的很多材料中都会散发出甲醛等有害气体 |
| C.纯甲醛俗称为福尔马林,可用来浸制生物标本 |
| D.甲醛溶液可以浸泡海鲜产品,以防止产品变质 |
下列物质中,不属于醇类的是
| A.C4H9OH | B.C6H5CH2OH | C.C6H5OH | D.甘油 |
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质说法中正确的是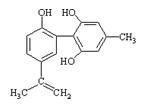
| A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 |
| C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol |
| D.该分子中的所有碳原子可能共平面 |