一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e- + H2O = CH3COOH + 4H+。下列有关说法正确的是( )
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e- + 2H2O = 4OH- |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al |
NaCl是一种化工原料,可以制备一系列物质(如下右图所示)。下列说法正确的是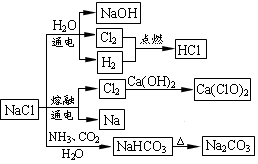
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
已知:强酸和强碱在稀溶液中发生反应时的中和热为57.3 kJ · mol-1,101 k Pa时辛烷的燃烧热为5518 kJ·mol-1。则下列热化学方程式书写正确的是
| A.H++OH-=H2O△H = -57.3kJ·mol-1 |
| B.2NaOH(aq)+ H2SO4(aq)= Na2SO4(aq)+2H2O(l)△H = -114.6 kJ·mol-1 |
| C.2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(g)△H = -11036 kJ·mol-1 |
| D.2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(l)△H = -5518kJ·mol-1 |
右图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
| A.当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112 mL |
B.负极反应为4Na 4e-=4Na+ 4e-=4Na+ |
| C.闭合K后,b电极附近的pH变小 |
| D.闭合K后,a电极上有产生氢气 |
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g) Z(g)+W(s);ΔH>0则下列叙述正确的是
Z(g)+W(s);ΔH>0则下列叙述正确的是
| A.加入少量W,逆反应速率增大 | B.升高温度,平衡逆向移动 |
| C.当容器中气体压强不变时,反应达到平衡 | D.平衡后加入Z,上述反应的ΔH增大 |