已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,据此判断下列说法正确的是( )
| A.反应生成物都属于电解质 | B.该反应表明氧化性Cl2比KClO3强 |
| C.HCl部分发生氧化反应 | D.1mol KClO3在反应中得到6mole- |
已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是
A.溶液的质量 |
B.Ca(OH)2的溶解度 |
| C.溶液中Ca2+离子的数目 | D.溶液中溶质的质量分数 |
下列离子方程式书写正确的是
A. 铝片放入NaOH溶液中:2Al+2OH- =2AlO2-+H2↑
=2AlO2-+H2↑
B. 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++CO2↑+H2O
C . 氯气通入NaOH稀溶液中:Cl2+2OH-=Cl-+ClO-+H2O
. 氯气通入NaOH稀溶液中:Cl2+2OH-=Cl-+ClO-+H2O
D. Ba(OH)2溶液与过量NaHSO4溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
某原电池装置如下图所示,下列有关叙述中,正确的是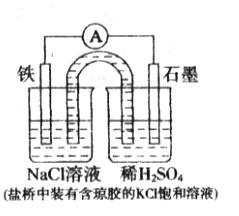
| A.Fe作正极,发生氧化反应 |
| B.负极反应:2H++2e-=H2↑ |
C.工作一段时间后 ,两烧杯中溶液p ,两烧杯中溶液p H均不变 H均不变 |
| D.工作一段时间后,NaCl溶液中c(Cl-)增大 |
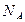 表示阿伏加德罗常数。下列说法正确的是
表示阿伏加德罗常数。下列说法正确的是
A.7.8gNa2O2中含有的阴离子数目为0.2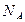 |
B.标准状况下,2.24 L CHCl3的分子数为0.1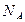 |
C.1 L 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2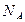 |
D.9.2g NO2和N2O4的混合气体中含有的氮原子数为0.2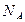 |
用惰性电极电解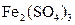 和
和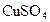 的混合液,且已知
的混合液,且已知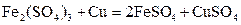 ,下列说法正确的是
,下列说法正确的是
A.阴极反应式为: ,当有 ,当有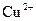 存在时 存在时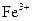 不放电 不放电 |
| B.阴极上首先析出铁,然后析出铜 |
| C.阴极上不可能析出铜 |
D.首先被电解的是 和 和 ,后被电解的是 ,后被电解的是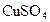 和 和 |