0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为( )
| A.0.30mol | B.0.22mol | C.0.16mol | D.0.48mol |
下列溶液:① CH3COOH ② HCl ③ NaOH ④ CH3COONa ⑤KCl ⑥NH4Cl其物质的量浓度均为0.1mol/L,其pH由大到小排列顺序为
| A.③④⑤⑥①② | B.④⑤⑥①③② |
| C.②①⑥⑤④③ | D.②③①⑥⑤④ |
已知①CH3COOH与CH3COONa等物质的量混合配成的稀溶液,pH为4.7;②用等物质的量的HCN和NaCN配成的稀溶液中,c(CN-)<c(Na+),则下列说法不正确的是
| A.CH3COONa的水解趋势大于CH3COOH的电离趋势 |
| B.NaCN的水解趋势大于HCN的电离趋势 |
| C.②溶液中,c(H+)<c(OH-) |
| D.CH3COONa的存在抑制了CH3COOH的电离 |
关于盐类水解反应的说法中正确的是
| A.溶液呈中性的盐一定是强酸与强碱反应生成的盐 |
| B.含有弱酸根离子的盐的水溶液一定呈碱性 |
| C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小 |
D.Na2S水解的离子方程式为:S2-+2H2O H2S+2OH- H2S+2OH- |
下列各组离子在溶液中一定能大量共存的是
| A.PH=0的溶液:K+、Ca2+、HCO3-、NO3- |
| B.c(H+)水=1×10-10 mol/L溶液中:K+、Fe2+、SO42-、NO3- |
| C.使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO42- |
| D.存在较多的Na+、SO42-、OH-的溶液中:Mg2+、Ba2+、Br- |
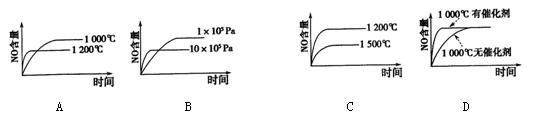
已知:4NH3 (g)+5 O2 (g) 4NO (g)+6 H2O (g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO (g)+6 H2O (g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是