下列离子方程式正确的是( )
| A.澄清石灰水中滴加稀硝酸:Ca(OH)2+2H+= Ca2++2H2O |
B.用Pt电极电解饱和氯化镁溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.向Fe(OH)3浊液中滴加HI溶液:Fe(OH)3+3H+ =Fe3++3H2O |
| D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++2HCO3—+2OH—=CaCO3↓+CO32—+2H2O |
近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性。下列有关说法正确的是
| A.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| B.高锰酸钾溶液和双氧水的消毒原理相同 |
| C.双氧水具有较强的腐蚀性,不能用于皮肤的消毒 |
| D.在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为
| A.2∶1 | B.1∶2 | C.1∶3 | D.1∶4 |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环。下列说法不正确的是
| A.阳离子交换膜可阻止Br2与Zn直接发生反应 |
| B.放电时负极的电极反应式为Zn-2e-=Zn2+ |
| C.充电时电极a连接电源的负极 |
| D.放电时左侧电解质储罐中的离子总浓度增大 |
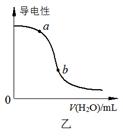
下列图示与对应的叙述相符的是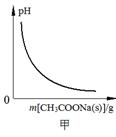


| A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 |
| B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| C.图丙表示催化剂能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1 mol·L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
B.等浓度、等体积的Na2CO3和NaHCO3混合: > > |
| C.0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |