设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.常温常压下4.6g NO2和N2O4混合气体所含原子总数为0.3NA |
| B.标准状况下,22.4L SO3的分子数为NA |
| C.将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA |
| D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
如图所示,对A生成C的反应,下列所得结论正确的是()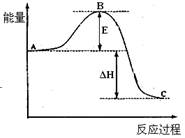
| A.该反应为吸热反应 |
| B.该反应进行时,一定有能量放出 |
| C.A物质比C物质稳定 |
| D.该反应肯定很容易,不需要加热就可以进行 |
用铝单质还原下列化合物,制得金属单质各1mol,需消耗铝最少的是()
| A.MnO2 | B.WO3 | C.Co3O4 | D.Cr2O3 |
以下推断或现象错误的是()
A.离子化合物可能完全由非金属元素组成
B.邻二氯苯没有同分异构体,说明苯分子中不存在单、双键交替相连的结构
C.A、B两种金属用导线相连接浸泡在稀硫酸溶液中,形成原电池,金属A作负极,金属B表面产生气泡,但同样金属A直接与该稀硫酸溶液反应时,溶解腐蚀的速度会更快
D.在3 mL 5%的H2O2溶液中,滴加2滴1mol/L的FeCl3溶液,观察到溶液颜色由黄色变到红褐色,当溶液无气泡产生后,溶液颜色又恢复至黄色,FeCl3在催化过程中可能参加了化学反应
假设某化学反应的反应过程如下图所示: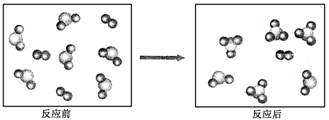
观察分析,符合图中变化的化学反应为 ()
A.A2+3B2 2AB3 2AB3 |
B.2AB2+B2 2AB3 2AB3 |
| C.2A2B+5B2===4AB3 | D.2AB2+B2===2AB3 |
下列各组微粒的半径比较中,正确的是 ()
①F<F-<Cl- ②O2-<Mg2+<Al3+ ③Na+<Na<Rb ④P<S<Cl
| A.①③ | B.②③ | C.③④ | D.①② |