某无色溶液含有①Na+、②Ba2+、③Cl—、④Br—、⑤SO32—;⑥SO42—离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液的pH大于7 |
| (2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
| (3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入Ag NO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是( )
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑥
C.不能确定的离子是① D.不能确定的离子是③⑤
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.含有0.1 mol/L NaClO的溶液中:Na+、K+、SO32-、Cl- |
| C.遇酚酞变红的溶液中:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NH4+ |
下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧;②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间;
③FeCl3溶液中滴入KSCN溶液;④无水硫酸铜放入医用酒精中。
| A.②③①④ | B.③②①④ | C.③①②④ | D.①②③④ |
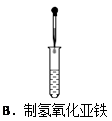
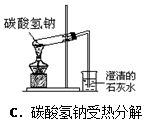
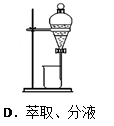
下列实验操作正确的是( ) 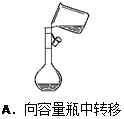
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )
| A.无水硫酸铜、蔗糖 | B.硅胶、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
下列叙述正确的是( ) 
| A.为提醒人们在使用浓H2SO4时注意安全,贮存浓H2SO4的容器应贴上图标识 |
| B.实验室可利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| C.大量氯气泄漏时,用NaOH浸湿毛巾捂住嘴和鼻,并迅速离开现场 |
| D.氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 |