已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl—、ClO—、ClO3—三种含氯元素的离子,其中ClO—、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。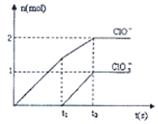
(1)t1前,氧化产物是________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为: 。
(3)该石灰乳中含有Ca(OH)2的物质的量是 mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是 。
| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。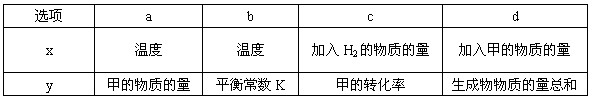
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。该反应的热化学方程式为________。
J。该反应的热化学方程式为________。
向盛有
溶液的试管中加入少许
后滴加氯水,
层 变成紫色。如果继续向试管中滴加氯水,振荡,
层会逐渐变浅,最后变成无色。
变成紫色。如果继续向试管中滴加氯水,振荡,
层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平
 层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
2)整个过程中的还原剂是。
3)把
换成
,则
层变为色:继续滴加氯水,
层的颜色没有变化。
、
、
氧化性由强到弱的顺序是。
4)加碘盐中含碘量为20
~50
/
。制取加碘盐(含
的食盐)1000
,若庄
与
反应制
,至少需要消耗
(标准状况,保留2位小数)。
接触法制硫酸工艺中,其主反应在
并有催化剂存在下进行:
1)该反应所用的催化剂是(填写化合物名称),该反应 时的平衡常数 时的平衡常数(填"大于"、"小于"或"等于").
2)该热化学反应方程式的意义是.
3)达到化学平衡状态的是
a.
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入
和
,半分钟后达到平衡,测得容器中含
,则
:若继续通入
和
,则平衡移动(填"向正反应方向"、"向逆反应方向"或"不"),再次达到平衡后,mol<
<mol。
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(
)等化合物。
1)三硅酸镁的氧化物形式为,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为。
2)铝元素的原子核外共有种不同运动状态的电子、种不同能级的电子。
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径(填"大"或"小"),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
4)
、
和
都可以制耐火材料, 其原因是。
a.
、
和
都不溶于水
b.
、
和
都是白色固体 c.
、
和
都是氧化物
c.
、
和
都是氧化物
d.
,
和
都有很高的熔点
有机化合物A~H的转换关系如下所示:
请回答下列问题:
(1)链烃A有南链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是 ,名称是 ;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是 ;
(4)①的反应类型是 ;③的反应类型是 ;
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊为烷,写出B所有可能的结构简式
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为 。