醋酸溶液中存在电离平衡:CH3COOH(aq) H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
己知反应A(g) + B(g)  C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
| 温度/℃ |
700 |
830 |
1200 |
| K值 |
1.7 |
1.0 |
0.4 |
A.达到平衡后,B的转化率为50%
B.增大压强,正、逆反应速率均加快
C.该反应为吸热反应,升高温度,平衡正向移动
D.反应初始至平衡,A的平均反应速率v(A) = 0.005 mol·L-1·s-1
下述根据下列操作和现象,所得结论正确的是
| 实验操作及现象 |
实验结论 |
|
| A |
分别向2 mL 0.1 mol·L-1 CH3COOH溶液和2 mL 0.1 mol·L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 |
酸性: CH3COOH > H2CO3> H3BO3 |
| B |
向2 mL 0.1 mol·L-1 NaOH溶液中滴加3滴0.1 mol·L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀 |
溶解度:Mg(OH)2>Fe(OH)3 |
| C |
在少量无水乙醇中加入金属Na,生成可以在空气中燃烧的气体 |
CH3CH2OH是弱电解质 |
| D |
用3 mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入 1 mL浓H2SO4,又迅速产生较多气泡 |
H2SO4浓度增大,反应速率加快 |
常温下,用 0.01 mol·L-1NaOH溶液滴定 20.00 mL 0.01 mol·L-1 CH3COOH溶液,所得滴定曲线如图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
某种药物合成中间体的结构简式为: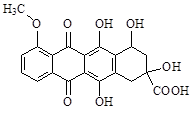 ,有关该物质的说法不正确的是
,有关该物质的说法不正确的是
| A.属于芳香族化合物 |
| B.能发生消去反应和酯化反应 |
| C.能分别与金属Na、NaHCO3溶液反应 |
| D.1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
M |
R |
Q |
|
| 原子半径(×10-10 m) |
1.86 |
0.99 |
1.43 |
1.60 |
0.75 |
0.74 |
|
| 主要化合价 |
最高正价 |
+1 |
+7 |
+3 |
+2 |
+5 |
—— |
| 最低负价 |
—— |
-1 |
—— |
——- |
-3 |
-2 |
已知,X、Y、Z和M下列说法正确的是
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Z、M的单质分别与水反应,Y最剧烈
D.Y的氢化物的水溶液可用于雕刻玻璃