关于反应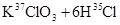

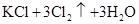 的有关叙述中,正确的是( )
的有关叙述中,正确的是( )
A.KCl中含有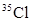 |
B.KCl中含有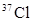 |
C.生成物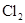 的相对分子质量大于71 的相对分子质量大于71 |
D.该反应转移电子数为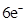 |
将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体仍无沉淀产生,则通入的气体可能是
| A.NH3 | B. Cl2 | C. CO2 | D.NO2 |
常温常压下,将下列各组气体分别充入到容积可变的密闭容器中, 充分反应后,恢复到原来状况时体积由大到小的顺序是:①2mol NH3和1mol HCl,②2mol SO2和1mol O2,③2molH2S和1mol SO2,④2mol NO和1mol O2,⑤1mol H2S和1mol Cl2
| A.②>④>⑤>①>③ | B.②>⑤>④>①>③ |
| C.④>②=⑤>③>① | D.④=⑤>②>③>① |
据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6)。已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应正确的是
| A.在此反应中,每生成1mol O2(PtF6)则转移1mol电子 |
| B.在此反应中,O2是氧化剂,PtF6是还原剂 |
| C.O2(PtF6)中氧元素的化合价是+1价 |
| D.O2(PtF6)中仅存在离子键不存在其它化学键 |
甲、乙、丙、丁四个烧杯内分别放人 0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入 100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁的质量分数大小的顺序是
| A.甲<乙<丙<丁 | B.丁<甲<乙<丙 | C.甲=丁<乙=丙 | D.丁<甲<乙=丙 |
下列离子方程式正确的是
| A.澄清石灰水中滴加稀硝酸:Ca(OH)2+2H+====Ca2++2H2O |
B.用Pt电极电解饱和氯化镁溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.向FeBr2溶液中通入过量氯气:2Fe2++Cl2====2Fe3++2Cl- |
| D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液: |
Ca2++ +2OH-====CaCO3↓+
+2OH-====CaCO3↓+ +2H2O
+2H2O