某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )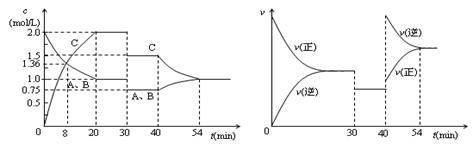
| A.8min前A的平均反应速率为0.08mol/(L·s) |
| B.30min时扩大容器的体积,40min时升高温度 |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.30min和54min的反应的平衡常数相等4 |
在一定温度下,将气体X和气体Y各0. 16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.0~2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡时v(正)< v(逆)
C.该温度下此反应的平衡常数K=144
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
下列图示与对应的叙述相符的是
| A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图Ⅱ表示常温下,0. 100 mol/L NaOH溶液滴定20. 00 mL、0.100 mol/L HC1溶液所得到的滴定曲线 |
| C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b |
D.图Ⅳ表示反应4CO(g)+2NO2(g)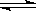 N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a |
X、Y、Z、W有如图所示的转化关系,则X、Y可能是
①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Cl2、FeCl3
A.仅有①③ B.①②③ C.仅有②④ D.①②③④
设NA为阿伏伽德罗常数的值。下列说法正确的是:
| A.0.2 mol Al与足量NaOH溶液反应,生成的H2体积为6.72L |
| B.常温下pH=1的盐酸溶液中的H+离子数目为0.1NA |
| C.铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.3NA |
| D.11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
用下列实验装置进行相应实验,能达到实验目的是: