(8分)在一定温度下,有a. 醋酸 b.硫酸 c.盐酸三种酸:
(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是
用a、b、c表示,下同)
(2) 当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 .反应所需时间的长短关系是______________________.
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是______________________.
(1)物质的量浓度相同的三种盐NX、NaY、NaZ的溶液,其pH依次为8、9、1 0,则HX、HY、HZ的酸性由强到弱的顺序是。
(2)比较下列溶液的pH(填“>”“<”或“=”):
①0.1 mol·L-1Na2CO3溶液0.1 mol·L-1NaHCO3溶液
②0.1 mol·L-1NH4Cl溶液0.01 mol·L-1NH4C1溶液
(3)把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c为负极;a、c相连,c为正极;b、d相连,b为正极,则这四种金属的活动性由强到弱的顺序为 。
(4)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是。
(5)氯化铁溶液呈性(填“酸”、“碱”或“中”),原因是(用离子方程式表示):
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,溶液的pH7(填“>”“<”或“=”),离子反应总方程式为:。
把2.0 mol CuSO4和1.0 mol
CuSO4和1.0 mol H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度
(2)混合液中和的物质的量浓度
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度。c(Fe2+)=_______________________。
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,试回答: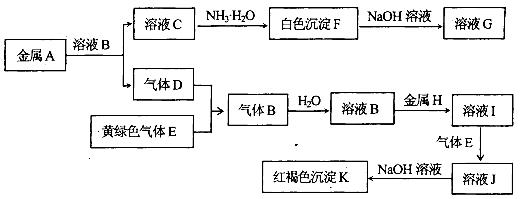
(1)写出下列物质的化学式:气体B是_____________,H是_______________,
(2)写出A与NaOH溶液反应的离子方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:_____________________________________________;
(4)写出反应“F→G”的离子方程式:____________________________________________;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
其反应的原理是(化学方程式)_________________________________________________.
(6)检验溶液J中的金属阳离子,用______________________试剂(填化学式),其现象是
_________________________________.
海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
(1)氯碱工业是以电解食盐水为基础化学工业,写出电解食盐水的化学方程式___________________________________________________________________.
(2)从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2)。流程示意图如下: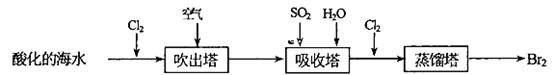
①写出氯气从NaBr中置换出溴单质的化学方程式:____________________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度。
②吹出的溴和大量空气混合在—起进入吸收塔,根据流程图分析,通入SO2和水的目的是。_____________________________________________________.(用化学方程式表示)
A、B、C、D、E、F六种物质的焰色反应均为黄色。 A、B、C、D与盐酸反应均生成E,此外B还生成—种可燃性气体;而C、D还生成—种无色无味的气体H,该气体能使澄清的石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另—种无色无味气体。
请回答下列问题:
(1)写出B、C的化学式:B:___________________; C:___________________;
(2)写出F和H2O反应的化学方程式:__________________________________;
(3)写出下列反应的离子方程式
①D溶液+盐酸:_____________________________________________________;
②D溶液+A溶液:___________________________________________________;