若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的是( )
| A.若n=2,则分子的立体构型为V形 | B.若n=3,则分子的立体构型为三角锥形 |
| C.若n=4,则分子的立体构型为正四面体形 | D.以上说法都不正确 |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠, 4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为: 2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极, |
铁为阴极
在含有大量Na+和NO3-的溶液中,能大量共存的离子组是
| A.H+ Fe3+ ClO-Cl- | B.H+ NH4+Fe2+ Br- |
| C.Ag+ K+ CO32-SO42- | D.K+ AlO2-Cl- OH- |
下列有关说法不正确的是
| A.能使品红试液褪色的气体不一定是SO2 |
B.胶黏剂UF结构为: ,可推测其单体为尿素和甲醇 ,可推测其单体为尿素和甲醇 |
C.CO2电子式为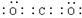 |
D.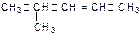 命名为4-甲基-2-戊烯 命名为4-甲基-2-戊烯 |
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题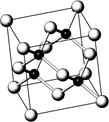
(1)下列说法正确的是▲(选填序号)。
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As>Ga
C.电负性:As>Ga D.砷和镓都属于p区元素
E.半导体GaP、SiC与砷化镓为等电子体
(2)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到, 该反应在700℃进行,反应的方程式为:▲。
AsH3空间形状为:▲(CH3)3Ga中镓原子杂化方式为:▲。
(3)Ga的核外电子排布式为:▲。
(4)AsH3沸点比NH3低,其原因是:▲。
TBC是优良的增塑剂,具有很好的相容性,且挥发性小、耐寒、耐光及耐水等,广泛用于医学卫生用品,它的结构式如右图,合成时柠檬酸与正丁醇合成数据如下:

下表中实验数据均为用活性炭固体杂多酸作催化剂,实验时催化剂总量占原料的1%,实验结果如下表。表1:酸醇物质的量之比对酯化率的影响;表2:酯化时间对酯化率的影响;表3:酯化率随温度变化情况。
| 表1 |
n(酸)︰n(醇) |
1︰5.0 |
1︰5.5 |
1︰6.0 |
1︰6.5 |
1︰7.0 |
| 酯化率/% |
95.1 |
96.3 |
97.0 |
97.4 |
97.2 |
|
| 表2 |
时间/h |
0.5 |
1.0 |
2.0 |
3.0 |
5.0 |
| 酯化率/% |
40.0 |
70.2 |
94.3 |
97.4 |
97.4 |
|
| 表3 |
温度/℃ |
130 |
140 |
145 |
150 |
160 |
| 酯化率/% |
89.5 |
96.2 |
97.4 |
97.4 |
97.2 |
试回答下列问题
(1)酯化反应适宜的条件n(酸)∶(醇)、时间/h、温度/℃分别是:▲(选填序号)。
A.1∶5,1,130 B.1∶5.5 ,1,140
C.1∶7 ,2,160 D.1∶6.5 ,3,145
(2)TBC的一种标准谱图如右,它是 ▲(A、1H-NMR图谱 B、红外光谱 C、质谱)
(3)TBC与足量NaOH溶液反应的化学方程式:▲。
(4)柠檬酸的一种同分异构体A,能发生如下转化:
A可能的结构式为:▲(只写一种)。