为使反应:Cu+2H2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是
| A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池 |
| B.用铜片作电极,外接直流电源电解硫酸铜溶液 |
| C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液 |
| D.用铜片作阴、阳电极,电解稀硫酸 |
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达错误的是
A.密闭容器中CuO和C高温反应的气体产物: 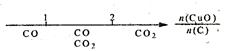 |
B.Fe在Cl2中的燃烧产物: 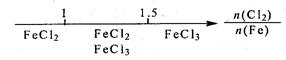 |
C.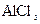 溶液中滴加NaOH后铝的存在形式: 溶液中滴加NaOH后铝的存在形式: 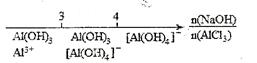 |
D.氨水与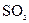 反应后溶液中的铵盐: 反应后溶液中的铵盐: |

国际无机化学命名委员会将长式元素周期表原先的主、副族号取消,从左往右改为18列,碱金属为第 1列,稀有气体为18列。按这个规定,下列说法错误的是
1列,稀有气体为18列。按这个规定,下列说法错误的是
| A.只有第2列元素的原子最外层有2个电子 |
| B.第3~12列中的元素都是金属元素 |
| C.室温时,第18列元素的单质都是气体 |
| D.第16、17列元素都是主族元素 |
下列各组离子一定能大量共存的是
A.常温下 的溶液: 的溶液: |
B.含有大量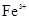 的溶液: 的溶液: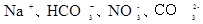  |
C.加入铝粉能产生氢气的溶液: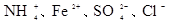 |
D.由水电离出的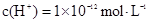 溶液: 溶液: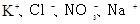 |
Fe、Mg、Al分别跟稀盐酸充分反应得到相同质量的氢气。其原因是:①Fe、Mg、Al的质量相等,盐酸足量; ②Fe、Mg、Al的质量比是56:24:27,盐酸足量; ③Fe、Mg、Al的质量比是28:12:9,盐酸足量;④Fe、Mg、Al均过量,所用盐酸的溶质质量分数和质量都相同。你认为可能的原因是:
| A.①② | B.①③ | C.②③ | D.③④ |
高铁酸钠 ( )对河水、湖水消毒是城市饮水处理的新技术。已知反应为:
)对河水、湖水消毒是城市饮水处理的新技术。已知反应为: ,下列说法正确的是
,下列说法正确的是
A. 既是氧化剂又是还原剂 既是氧化剂又是还原剂 |
B. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
C.3mol 发生反应,有12mol电子转移 发生反应,有12mol电子转移 |
D.在 中Fe为+4价,具有强氧化性,能消毒杀毒 中Fe为+4价,具有强氧化性,能消毒杀毒 |