在玻璃圆筒中盛有两种无色的互不相溶的中性液体,上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.根据上述实验回答: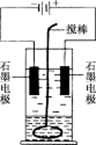
(1)阳极上的电极反应式为________.
(2)阴极上的电极反应式为________.
(3)原上层液体是________.
(4)原下层液体是________.
(5)搅拌后两层液体颜色发生变化的原因是__________________________________.
(6)要检验上层液体中含有的金属离子,其方法是______________________________,现象是__________________________________.
(9分)如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答: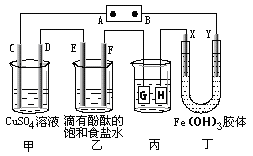
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。
(10分) (1)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的________腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的________极(填“正”或“负”)相连。
(2)基态Fe原子有 个未成对电子,Fe2+的电子排布式为 。可用铁氰化钾溶液检验 Fe2+,发生反应的离子方程式为 。
(3)用惰性电极电解200mL一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积变化),通电一段时间后,若向所得的溶液中加入0.1molCu (OH)2,溶液恰好恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为________ mol。
(4)用铂作电极电解AlCl3溶液的总反应离子方程式为 。
(9分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
⑩ |
① |
② |
③ |
||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在下列横线上填写“大于”、“小于”、“等于”。
第一电离能:② ③;电负性:② ③;非金属性:① ⑦;离子半径:④ ⑥。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:__________;碱性最强的化合物的电子式为:_______________。
(3)最高价氧化物是两性氧化物的元素是__________ (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式______________________________________________。
观察下列实验装置图,试回答下列问题:
(1)写出图中四种实验操作的名称________、________、________、________。
(2)写出装置④中所用玻璃仪器的名称_____________、____________。
(3)下列实验需要在哪套装置中进行(填序号):
从海水中提取蒸馏水:________;分离氯化钠和水:_______;分离碳酸钙和水:________;分离植物油和水:________。
可用于分离或提纯物质的方法有:①过滤,②蒸馏,③加热,④分液(在下列横线上填写分离提纯的合理方法的序号)。
(1)除去石灰水中悬浮的CaCO3颗粒:________。
(2)除去NaCl晶体中混有的碘单质:________。
(3)分离汽油和煤油的混合物:________。
(4)分离水和苯的混合物:________。