某学生试图用电解法根据电极上析出物质的质量来验证阿伏伽德罗常数的值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图:
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g.
试回答:
(1)连接这些仪器的正确顺序为:(用图中标注仪器接线柱的英文字母表示,下同)E接________,C接________,________接F.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为__________________,相应的离子方程式是__________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________.(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电荷量为1.6×10-19C.试列出阿伏伽德罗常数的计算表达式:NA=________.
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程。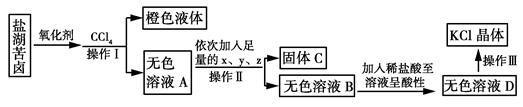
研究性学习小组查寻资料得知:Br-被氧化剂氧化成溴。溴不易溶于水而易溶于CCl4回答以下问题:
(1)操作Ⅰ的名称为______________;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还有________ 。
(2)试剂x,y,z的化学式分别为x,_______ y z _;检验SO42-已除尽的方法是 。
(3)写出操作Ⅲ的具体操作步骤_________________________。
2 mol O3和3 mol O2的质量之比______________,分子数之比______________,同温同压的密度之比为______________,含氧原子数之比为______________,体积之比为______________。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。首先不用其他试剂就可鉴别出的是 ,如要继续鉴别余下两种,还需要选用的试剂是 ,现象分别为 。
对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ____________________
(2)除去食盐溶液中的水 ______________________
(3)淡化海水 ______________________
(4)KCl中含有KClO3_____________________
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
(1)该反应的化学方程式为______
(2)反应开始至2min,用Z表示的平均反应速率为______