(14分)某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物(水除外),他们设计的实验装置如下图所示:
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式: ;
(2)装置B的作用是 ;指出上述装置中的不足之处: 。
(3)实验结束后向装置B的试管中加入少量酸性高锰酸钾溶液,可以观察到的实验现象是溶液由褪色,反应的离子方程式为 。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组进一步探究:
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是 。
②取该红色固体与足量的稀硝酸反应,写出反应的化学方程式 。
现用18.4 mol·L-1的浓H2SO4来配制250 mL、0.300 mol·L-1的稀H2SO4。可供选择的仪器有:①药匙②量筒③ 托盘天平④玻璃棒⑤烧瓶
托盘天平④玻璃棒⑤烧瓶
⑥胶头滴管⑦容量瓶⑧烧杯。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
(2)经计算,需浓H2SO4的体积为。
现有① 5 mL②10 mL③20 mL三种规格量筒,你选用的量筒是(填代号)。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。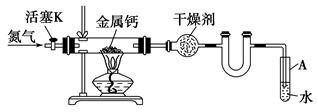
(1)若装置中 不用U型管,实验也能顺利进行,原因是:
不用U型管,实验也能顺利进行,原因是:
(2)反应过程中末端导管必须始 终插入试管A的水中,目的是
终插入试管A的水中,目的是
①便于观察N2的流速
②________
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,熄灭酒精灯,________
④拆除装置,取出产物。
(4)数据记录如下:
①空瓷舟质量m0/g;②瓷舟与钙的质量m1/g;
③瓷舟与产物的质量m2/g
①计算得到实验式CaxN2,其中x=________(用m0、m1、m2表示)
②若通入的N2中混有少量O2,理论值比实际测得x值(填“偏大”或“偏小”)
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶 液中,片刻后取出观察,铁钉表面无明显变化,其原因是
液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用(填序号)。
| A.KSCN溶液和氯水 | B.铁粉和KS CN溶液 CN溶液 |
C.浓氨水 | D.酸性KMnO4溶液 |
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为
【探究二】
分析上述实验中SO2体积分数的结果,丙同学认为气体 Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。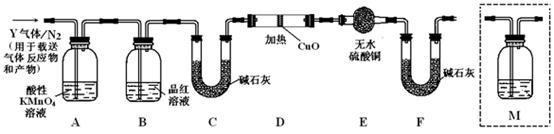
(3)装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加洗气瓶M于(选填序号)。
a. A之前 b. A-B间 c. B-C间 d. C-D间
( 6)如果气体Y中含有H2,预计实验现象应是
6)如果气体Y中含有H2,预计实验现象应是
实验来源于生活且服务于生活,请回答些列问题:
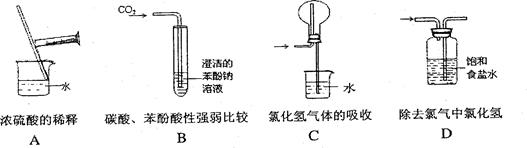
(1)正确的实验操作是实验成功的重要因素,下列实验操作错误的是( )
)
(2)由图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体。挤压滴管的胶头,下列与实验事实不相符的是()(注:不考虑导管被堵塞)
A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉
(3)设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有
小孔的试管制简易的气体发生器(见图)。若关闭K,不能使反应停止,可将试管
从烧杯中取出(会有部分气体逸散)。下列气体的制取宜使用该装置的是( ) 
A.用二氧化锰(粉末)与浓盐酸制氯气
B.用锌粒与稀硫酸制氢气
C.用碳酸钠固体与盐酸制二氧化碳
D.用碳酸钙(块状)与稀硫酸制二氧化碳
(4)为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
| 物质 |
试剂 |
分离方法 |
|
| ① |
硝酸钾(氯化钠) |
蒸馏水 |
重结晶 |
| ② |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
| ③ |
乙醇(水) |
生石灰 |
蒸馏 |
| ④ |
SiO2(Al2O3) |
NaOH溶液 |
过滤 |
A.①② B.①③ C.只有③ D.③④
有一种白色粉末,含有下列阴离子和阳离子中的几种,阴离子:S2- 、MnO4-、NO3-、SO42-、CO32-,阳离子:Na+、Al3+、Ba2+、Fe3+、NH4+,将白色粉末进行下列实验,实验操作及观察到现象如下:
a、取少量粉末加水振荡,现象是:全部溶解,溶液无色透 明;
明;
b、向所得溶液慢慢滴入苛性钠溶液并加热,现象是:无明显现象;
c、取少量粉末加盐酸,现象是:无明显现象;
d、取少量粉末加稀硫酸和稀硝酸混合液,现象是:有不溶于稀硝酸的白色沉淀生成。
根据实验推断:
(1)从a实验中可推断粉末中一定没有________离子;
(2)从b实验中可推断粉末中一定没有________离子;
(3)从c实验中可推断粉末中一定没有________离子;
(4)从d实验中可推断粉末中必定含有________离子;
(5)综上所述,粉末中还可能含有_______ _离子
_离子