胶体区别于其它分散系的本质是( )
| A.胶体的分散质粒子直径在1 nm~100nm之间 |
| B.胶体粒子带电荷并且在一定条件下能稳定存在 |
| C.胶体粒子不能穿过半透膜,能通过滤纸空隙 |
| D.胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
下列说法正确的是
| A.制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 |
| B.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI) |
| C.0.1mol·L-1的NaOH溶液分别中和pH、体积均相等的醋酸和盐酸,所消耗NaOH溶液的体积:前者小于后者 |
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
下列有关化学概念或原理的论述中正确的是
| A.由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 |
| B.电解精炼铜,电解结束后电解质溶液浓度不变 |
| C.海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
硫酸的产量是衡量一个国家化工水平的标志。2SO2(g) + O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| 甲 |
乙 |
丙 |
||
| 起始物质的量 |
n(SO2) / mol |
0.4 |
0.4 |
0.8 |
| n(O2) / mol |
0.24 |
0.48 |
0.48 |
|
| SO2的平衡转化率 |
80% |
α1 |
α2 |
|
下列判断中,正确的是
A.甲中反应的平衡常数大于乙
B.平衡时,SO2的转化率:α1<80%<α2
C.该温度下,乙中平衡常数值为400
D.平衡时,丙中c(SO3)是甲中的2倍
用来表示可逆反应2A(g) + B(g) 2C(g) ;△H<0的正确图像为
2C(g) ;△H<0的正确图像为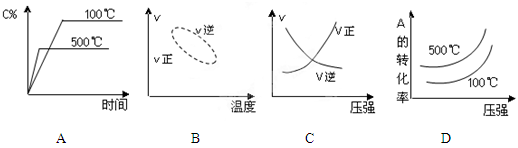
可逆反应aA(s)+bB(g) cC(g)+dD(g),反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是
cC(g)+dD(g),反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是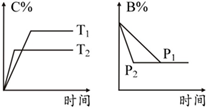
| A.T1>T2 | B.正反应为放热反应 |
| C.P1>P2 | D.a+b=c+d |