将气体A、B置于容积为2 L的密闭容器中,发生如下反应:4A(g)十B(g)=2C(g)
反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol。则用反应物A浓度的减少来表示该反应的速率应为( )
A. 0.05 mol/(L·s) B. 0.012 5 mol/(L·s)
C. 0.025 mol/(L·s) D. 0.1 mol/(L·s)
某有机物A是农药生产中的一种中间体,其结构简式如下图。则下列叙述正确的是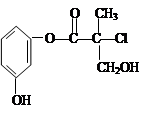
| A.有机物A属于芳香烃 |
| B.有机物A可以和Br2的CCl4溶液发生加成反应 |
| C.有机物A和浓硫酸混合加热,可以发生消去反应 |
| D.1molA和足量的NaOH溶液反应,最多可以消耗4mol NaOH |
人造象牙的主要结构是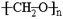 ,它是通过加聚反应制得,则合成人造象牙的单体是
,它是通过加聚反应制得,则合成人造象牙的单体是
| A.(CH3)2O | B.HCHO | C.CH3CHO | D.H2N-CH2-CO-NH2 |
下列有机物命名正确的是
| A.CH3(CH2)4CH3 1,4-二甲基丁烷 | B.CH3CH(CH3)CH=CH2甲基丁烯 |
| C.CH3CH2CH(CH3)2 2-甲基丁烷 | D.CH2ClCH2Cl二氯乙烷 |
1-溴丙烷和2-溴丙烷分别与NaOH的乙醇溶液共热,关于这两个反应的说法正确的
| A.产物相同,反应类型相同 | B.产物不同,反应类型不同 |
| C.碳氢键断裂的位置相同 | D.碳溴键断裂的位置相同 |
下列五种有机物:①甲烷②乙烯③乙炔④3-甲基戊烷⑤甲苯,某同学在分类时将①④⑤划为一类,②③划为一类。将①④⑤划为一类的依据是
| A.①④⑤均为烃类物质 |
| B.①④⑤均不能发生加成反应 |
| C.①④⑤在光照下均能与Cl2发生取代反应 |
| D.①④⑤均不能使酸性高锰酸钾溶液褪色 |