把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图2-1-1表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )。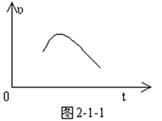
A ①④ B ①②③ C ③④ D ②③
试管中盛有少量白色固体,可能是铵盐,检验的方法是
| A.加水,将湿润的红色石蕊试纸放在试管口 |
| B.加NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口 |
| C.加NaOH溶液,加热,滴入酚酞试剂 |
| D.加NaOH溶液,加热,滴入紫色石蕊试剂 |
下列物质中属于电解质的是
| A.氢氧化钠固体 | B.二氧化碳气体 | C.铜丝 | D.氨水 |
关于2mol CO2的叙述中,正确的是
| A.体积为44.8L | B.质量为88g |
| C.分子数为6.02×1023 | D.含有4mol原子 |
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体,在同温同压下,两容器内的气体一定具有相同的
| A.分子数 | B.密度 | C.质量 | D.质子数 |
对于相同物质的量的SO2和SO3,下列说法中正确的是
| A.氧元素的质量比为1∶1 |
| B.分子数之比为1∶1 |
| C.原子总数之比为1∶1 |
| D.质量之比为1∶1 |