A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为2:6:3,则A、B、C三种醇的羟基数之比为
A.3:2:1 B.3:1:2 C.2:1:3 D.2:6:3
早在1807年化学家戴维用电解熔融氢氧化钠制得钠: ;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠: 。下列有关说法正确的是
。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电解反应为2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数不同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极 |
下列图示中关于铜电极的连接错误的是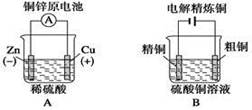
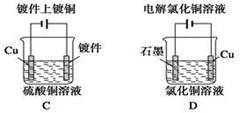
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是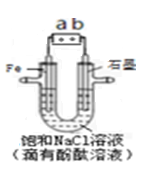
| A.a 为电源的正极 |
| B.通电一段时间后,石墨电极附近溶液先变红 |
| C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑ |
D.电解饱和食盐水的总反应是: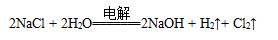 |
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是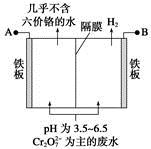
| A.A为电源正极 |
| B.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| C.阴极区附近溶液pH降低 |
| D.若不考虑气体的溶解,当收集到H213.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |