能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。已知拆开1 mol H-H键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
如右图装置,烧杯中盛有饱和食盐水,X、Y是两块石墨电极,两电极通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液,请回答以下问题: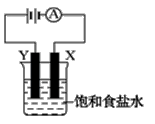
①该装置最主要的能量转化为_________________
②在X电极附近溶液中可观察到的现象是 X电极上发生_______反应(填“氧化”或“还原”),电极反应式为_____________________。
③检验Y电极上产物的方法是 。
④装置的总反应化学方程式是 。
X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图;其中元素W在周期表中的位置。
(2)用电子式表示X在空气中生成的氧化物的形成过程:。
(3)X、Y、Z、W的原子半径由大到小的顺序为:。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式:。
(5)写出Z与氢元素形成的10电子微粒化学式(任写两种)。
(6)元素X与元素Y相比,金属性较强的是(用元素符号表示),请举一例实验事实证明这一结论。
21世纪最富有挑战性的课题之一是使汽油氧化直接产生电流,新研制的某汽油燃料电池的一个电极通入空气,另一个电极通入汽油蒸气,用NaOH溶液作电解质溶液。填写下列空格。
(1)汽油_____________(选填“有”或“没有” )固定的熔沸点。炼制汽油的原料是石油,工业上生产汽油的常用方法是。(填序号)
①分馏 ②干馏 ③裂化 ④聚合
(2)汽油中有一种烃的成分为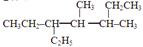 ,它的分子式是,名称是。
,它的分子式是,名称是。
(3)汽油燃料电池的能量转换形式是将能直接转化为能。通入空气的那个电极是燃料电池极(选填“正”或“负”)。若汽油的组成用上述烃的分子式表示,则负极的电极反应式为。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________。
(2)该反应为__________反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是__________(多选扣分)。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃。
(14分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________ , ______________ , _______________。
(3)以下各小题均为常温下的溶液
j某溶液中由水电离的c(H+)=10-10mol·L-1,则该溶液的pH为__________。
k盐类水解的逆反应是中和反应(填“对”或“错”)
lHCO3—溶液呈碱性说明HCO3—的电离能力弱于水解能力(填“对”或“错”)
m盐溶液显酸碱性,一定是由水解引起的(填“对”或“错”)
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)  Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 ml蒸馏水 ②100 mL 0.3 mol·lL-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为_______________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
(1)氯化铝水溶液呈性,原因是(用离子方程式表示):
。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是,Al2(SO4)3溶液蒸干最后得到的固体产物是;
(2)NaHCO3的水溶液呈(填“酸”、“中”或“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用塞,原因是(写出有关的离子方程式);
(3)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是。
(4)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号);④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)。