在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A.NH4+、Ba2+、Cl-、NO3- | B.K+、AlO2-、Cl-、SO42- |
| C.Ca2+、Mg2+、NO3-、HCO3- | D.Na+、Cl-、CO32-、SO32- |
下列关于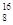 O的叙述正确的是
O的叙述正确的是
| A.质量数为8 | B.质子数为8 |
| C.中子数为16 | D.电子数为16 |
下列各组离子在水溶液中能大量共存的是
| A.Na+、NH4+、HCO3-、OH- | B.Cu2+、Fe3+、Cl-、NO3- |
| C.H+、Fe2+、Cl-、NO3- | D.H+、A13+、Cl-、SO42- |
设NA为阿伏加德罗常数,下列说法正确的是:
| A.NA的精确值为6.20×1023 mol-1 |
| B.18克水所含氢原子数为2NA |
| C.4.48L氧气所含分子数0.2 NA |
| D.2.4 g镁变成Mg2+时,失去电子数目为0.2 NA |
对下列物质用途的描述符合事实的是
| A.氯水可以漂白杀菌 | B.铝制容器可以贮运稀硝酸 |
| C.过氧化钠可用作潜艇供氧剂 | D.Fe2O3可用作外墙涂料 |
在下列自然资源的开发利用中,涉及化学变化的是
| A.用蒸馏法淡化海水 | B.用铁矿石冶炼铁 |
| C.用石油裂解生产乙烯 | D.煤的气化和液化 |