某实验小组利用粗硅与氯气反应生成SiCl4粗产品(含有FeCl3、AlCl3等杂质且SiCl4遇水极易水解),蒸馏得四氯化硅(SiCl4的沸点57.7℃),再用氢气还原制得高纯硅;用滴定法测定蒸馏后残留物(将残留物预处理成Fe2+)中铁元素含量。采取的主要操作如图,能达到实验目的是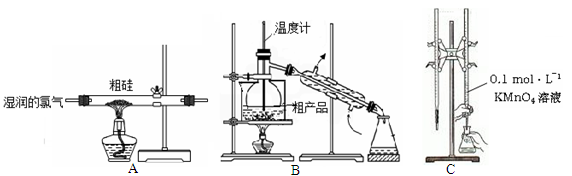
| A.用装置A完成SiCl4的制备 |
| B.用装置B进行蒸馏提纯SiCl4 |
| C.用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 |
| D.配制0.1 mol·L—1 KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
常温时,将0.1mol Fe(NO3)3和2mol HCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是
| A.由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+= 3Fe2+ |
| B.当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 |
| C.在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 |
| D.m至少等于28 g,反应过程中溶液的质量一直在减小 |
根据反应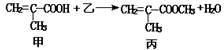 判断下列说法中不正确的是
判断下列说法中不正确的是
| A.乙物质为甲醇 |
| B.该反应为取代反应 |
| C.甲与乙都能与金属钠反应产生氢气 |
| D.甲、乙、丙都能与溴的四氯化碳溶液发生加成反应 |
A、B、C、D是原子序数依次增大但互不同主族的短周期元素,A2¯与B3+有相同电子层结构,C、D同周期但不相邻,C的最外层电子数是次外层电子数的一半,下列判断正确的是:
A.对应简单离子半径的大小顺序为:D>B>A
B.C的最高价氧化物对应水化物的酸性比D的强
C.A分别与B、C形成的化合物中化学键类型相同
D.B、C单质均能和氢氧化钠溶液发生反应生成氢气
下列有关描述正确的是:
| A.采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 |
| B.酸性氧化物均能与水反应生成对应的酸,如CO2、SiO2、SO3 |
| C.石油化工中的裂化、裂解过程都是通过化学反应来获得气态烯烃 |
| D.乙醇、过氧化氢、次氯酸钠等均通过氧化作用达到杀菌消毒的目的 |