对于标准状况下由N2、CO和C2H4组成的混合气体14g,下列说法可能错误的是( )
| A.体积是11.2L |
| B.分子数为0.5NA(其中NA表示阿伏加德罗常数的值) |
| C.密度为1.25g·L-1 |
| D.V(N2):V(CO):V(C2H4)=1:1:1 |
某有机物结构简式为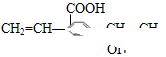 有关它的描述不正确的是
有关它的描述不正确的是
| A.既能与碳酸氢钠溶液反应,也能与溴水反应 |
| B.1mol该物质与足量Na反应产生1molH2 |
| C.最多可共面的碳原子数为10个 |
| D.可在铜的作用下发生催化氧化但不生成醛 |
下列有关化学用语使用正确的是:
A.CH4分子的比例模型: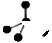 |
B.聚丙烯: |
| C.已烯的结构简式:CH2CH2 | D.羟基的电子式: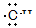 |
下列有机物分子中,所有原子不可能在同一平面内的是
120°时,将1体积某气态烃与7体积氧气混合完全燃烧后恢复到原来的温度和压强时气体体积变为原来的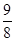 ,则该烃分子式不可能为
,则该烃分子式不可能为
| A.C3H8 | B.C4H8 | C.C5H8 | D.C7H8 |
设阿伏加德罗常数的值为NA,下列说法中正确的是
| A.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| B.1mol 苯乙烯中含有的碳碳双键数为4NA |
| C.0.1mol CnH2n+2中含有的碳碳单键数为0.1n NA |
| D.标准状况下,2.24L CHCl3含有的分子数为0.1NA |