已知298K时,2SO2(g)+O2(g)=2SO3(g) ∆H=-197kJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量Q1;向另一体积相同的密闭容器中通入1molSO2和1molQ2,达到平衡时放出的热量Q2;则下列关系正确的是( )
| A.2Q2=Q1 | B.2Q2<Q1 | C.Q2<Q1<197kJ | D.Q2=Q1<197kJ |
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能加快反应速率的是:
2NO在密闭容器中进行,下列措施能加快反应速率的是:
| A.改变温度 | B.恒容,充入N2 |
| C.恒容,充入He气 | D.恒压,充入He气 |
根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l)ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(l)ΔH=-Q2 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(g)ΔH=-Q3 kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是 ( )
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 |
| C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
把0.6 mol X气体和0.4 mol Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g)  nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式中n的值是( )
nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式中n的值是( )
| A.1 | B.2 | C.3 | D.4 |
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+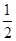 O2(g)ΔH=-266 kJ·mol-1
O2(g)ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-532kJ·mol-1 |
| D.CO2(g)与Na2O2(s)反应放出532 kJ热量时,转移电子数为6.02×1023 |
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)  2C(g)达到平衡标志的是( )
2C(g)达到平衡标志的是( )
①C的生成速率与C的分解速率相等②单位时间内a mol A生成,同时生成 3amolB③A、B、C的浓度不再变化④混合气体的总压强不再变化⑤混合气体的物质的量不再变化⑥单位时间消耗 a mol A,同时生成3a mol B ⑦A、B、C的分子数目比为1:3:2
A.②④⑤ B.②⑦ C.①③④ D.⑤⑥