PH3是一种无色剧毒气体,其分子结构和NH3相似。下列判断错误的是( )
| A.PH3分子呈三角锥形 |
| B.PH3和NH3分子中孤对电子数相同 |
| C.PH3分子中H原子之间是非极性键 |
| D.PH3分子稳定性低于NH3分子,因为 N-H键键能高 |
下列生活中的现象,不涉及化学变化的是()
| A.用糯米酿酒 | B.用干冰进行人工降雨 |
| C.用过氧乙酸杀菌消毒 | D.绿色植物的光合作用 |
四个体积相同的密闭容器中在一定的条件下发生反应:2SO2+O2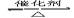 2SO3,反应开始时,反应速率由大到小排列顺序正确的是()
2SO3,反应开始时,反应速率由大到小排列顺序正确的是()
| 容器 |
温度 |
SO2(mol) |
O2(mol) |
催化剂 |
| 甲 |
5000C |
10 |
5 |
- |
| 乙 |
5000C |
8 |
5 |
V2O5 |
| 丙 |
4500C |
8 |
5 |
- |
| 丁 |
5000C |
8 |
5 |
- |
A.乙>甲>丁>丙 B.乙>甲>丙>丁 C.甲>乙=丁>丙 D.乙>甲>丙=丁
高温下,某反应达平衡,平衡常数K=。恒容时,温度升高,H2浓度减小。下列说法正确的是()
| A.该反应的焓变为正值 |
B.该反应化学方程式为:CO + H2 O CO2 + H2 + CO2 CO2 + H2 + CO2 |
| C.增大压强,H2浓度一定不变 |
| D.升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
右图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是()
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A (g)  2 B(g) + C(g)
2 B(g) + C(g)
用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是()
| A.CuSO4 | B.Na2SO4 | C.CuCl2 | D.NaCl |