以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下: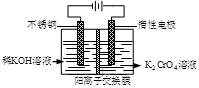
下列说法不正确的是
| A.在阴极室,发生的电极反应为:2H2O+2e—=2OH—+H2↑ |
| B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡 2CrO42—+2H+  Cr2O72—+H2O向右移动 Cr2O72—+H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr )为d,则此时铬酸钾的转化率为1- |
某温度、压强下,将一定量反应物通入密闭容器进行反应
SiCl4(g)+2H2(g) Si(s)+4HCl(g); ΔH=+QkJ/mol(Q>0),下列叙述正确的是 ( )
Si(s)+4HCl(g); ΔH=+QkJ/mol(Q>0),下列叙述正确的是 ( )
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态 |
| D.使用过量的H2或升高温度都可以提高SiCl4的转化率 |
下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.在反应A(g)+3B(g)=2C(g)+2D(g)的速率测定实验中,分别测得反应速率如下:v(A)= 0.15mol·L-1·s-1,
v (C)="0.3" mol·L-1·s-1,则用C来表示反应进行的速率更快。
C.如图所示,在一U型管中装入含有紫色石蕊试液的Na2SO4溶液,通直流电,一段时间后U型管内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是:红、紫、蓝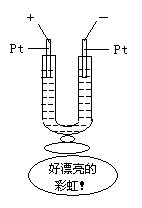
D.反应HCl(aq) + NaOH(aq) =" NaCl" (aq) + H2O(l)△H < 0, 在理论上能用于设计原电池。
已知:在100℃时,纯水的c(H+)为1×10—6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为()
| A.1∶9 | B.10∶1 | C.9∶1 | D.1∶10 |
某温度下在密闭容器中发生如下反应:2M(g)+ N(g) 2E(g),若开始时只充入2 mol E气体,达到平衡时,混合气体的压强比起始增大了20%;若开始时只充入了3 mol M和1 mol N的混合气体,达到平衡时M的转化率为( )
2E(g),若开始时只充入2 mol E气体,达到平衡时,混合气体的压强比起始增大了20%;若开始时只充入了3 mol M和1 mol N的混合气体,达到平衡时M的转化率为( )
| A.<60% | B.=40% | C.<40% | D.>60% |
用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是()
| A.电解过程中,b电极表面先有红色物质析出,后有气泡产生 |
| B.a电极上发生的反应方程式为:2H+ +2e- = H2↑和 4OH--4e- = 2H2O + O2↑ |
| C.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化 |
| D.从P到Q点时收集到的混合气体的平均摩尔质量为12g·mol-1 |