100 mL KNO3和Cu(NO3)2的混合溶液中c(NO3—)=6.0 mol/L,用石墨作电极电解此溶液,通电一段时间后,两极均收集到4.48 L气体(标准状况),假定电解后溶液体积仍为100 mL,下列说法不正确的是
| A.原混合溶液中c(K+)=1 mol/L |
| B.上述电解过程中一共转移电子0.8 mol |
| C.电解得到的铜的物质的量为0.2 mol |
| D.电解后溶液中c(H+)=2 mol/L |
下列说法正确的是
| A.1mL pH=2的醋酸溶液加水稀释到10mL,pH变为3 |
B.常温下,Na2CO3溶液中加水稀释时, 增大 增大 |
| C.向氯水中加入少量NaOH溶液,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.NH4Cl溶液稀释过程中.c(NH4+)与c(NH3·H2O)之和始终保持不变 |
室温时,HA溶液和HB溶液分别加水稀释,溶液的pH变化如图所示。下列说法不正确的是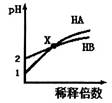
| A.HB一定是弱酸 |
| B.在x点,c(A-)=c(B-) |
| C.稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 |
| D.取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |
反应H2+C12=2HCl(△H<0)的机理包含:
①C12→2C1(慢)
②H2+Cl→HCl+H (快)
③C12+H→HCl+Cl(快)等。下列说法不正确的是
| A.断开lmol H-H键需要的能量大于断开1mol Cl-Cl键需要的能量 |
| B.反应H2+C12=2HCl在光照和加热条件下的△H不同 |
| C.反应①的活化能大于反应②的活化能 |
| D.已知反应②的△H>O,则反应③的△H一定小于0 |
下列离子组一定能大量共存的是
| A.pH=1的无色溶液中:K+、NH4+、SO42-、MnO4- |
| B.水电离出的c (OH-)=10-12 mo1·L-1的溶液中:Fe2+、Ba2+、NO3-、ClO- |
| C.含大量A13+的溶液中:Na+、SO42-、NO3-、[Al(OH)4]- |
| D.CO2的饱和溶液中:K+、Ca2+、Cl-、NO3- |
下列实验装置正确并能达到实验目的的是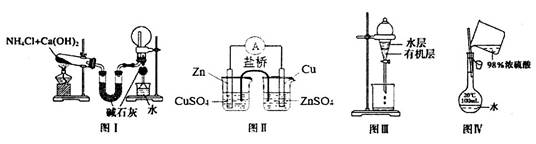
| A.图I用于制氨气并收集干燥的氨气 |
| B.图II是实现化学能转化为电能的铜锌原电池的原理示意图 |
| C.图III是用CCl4提取碘水中的I2 |
| D.图Ⅳ用于配制100mL0.2 mo1·L-1的硫酸溶液 |