25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ/mol
下列说法正确的是
| A.①和②生成等物质的量的产物,转移电子数不同 |
| B.①和②产物的阴阳离子个数比不相等 |
| C.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
| D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
下列有关实验的说法不正确的是
| A.当沉淀的颗粒较大时,也可用倾析法将固体和溶液分离 |
| B.结晶时,若溶质的溶解度越大,或溶液的浓度越高、或溶剂的蒸发速度越快,析出的晶粒就越细小 |
| C.利用硝酸和硝酸银溶液可区分工业盐和食盐 |
| D.制备阿司匹林时可能混有少量的聚合物杂质,可用碳酸氢钠溶液进行提纯 |
以下关于纸层析的叙述,错误的是
| A.纸层析法适用于分离和检验化学性质十分相近的分子或离子 |
| B.用纸层析法可以检验氯化铁溶液中是否混有少量氯化铜 |
| C.纸层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置的色斑 |
| D.为了看到色斑,只有有色离子的检验才可以用纸层析法 |
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法不正确的是
| 序号 |
被提纯的物质 |
除杂试剂 |
分离方法 |
| A |
碳酸氢钠粉末(Na2CO3) |
H2O、CO2 |
加热结晶 |
| B |
氯化钾溶液(FeCl3) |
氢氧化钾溶液 |
过滤 |
| C |
乙烷气体(乙烯) |
溴水 |
洗气 |
| D |
二氧化碳(二氧化硫) |
饱和NaHCO3溶液 |
洗气 |
下列结论均出自《实验化学》中的实验,其中错误的是
| A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 |
| B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
| C.镀锌铁皮发生电化学腐蚀时,锌发生氧化反应 |
| D.食醋的总酸含量是指食醋中醋酸的总物质的量浓度 |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指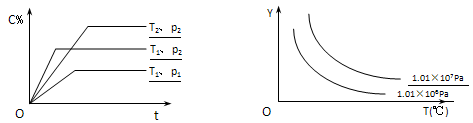
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量