加热N2O5依次发生的分解反应为:
①N2O5(g)  N2O3(g)+O2(g) ②N2O3(g)
N2O3(g)+O2(g) ②N2O3(g)  N2O(g)+O2(g)
N2O(g)+O2(g)
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为
| A.1.8mol/L | B.0.9 mol/L | C.2.3 mol/L | D.4.0 mol/L |
下列图示实验合理的是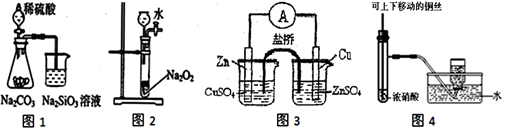
| A.图1证明非金属性强弱:S>C>Si |
| B.图2可制备少量氧气 |
| C.图3构成铜锌原电池,产生持续稳定的电流 |
| D.图4可制备并收集NO2气体 |
下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末的反应 | D.氧化钙溶于水 |
在某一化学反应,0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为
| A.3mol/L | B.0.3mol/L•s | C.0.6mol/L•s | D.0.1mol/L•s |
【改编】下列物质中,含有非极性共价键的化合物是
| A.H2 | B.H2O2 | C.KOH | D.CO2 |
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是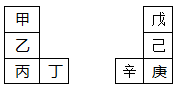
| A.金属性:甲>乙>丁 |
| B.原子半径:辛>戊>甲 |
| C.丙与庚的元素原子核外电子数相差13 |
| D.形成的最简单氢化物的稳定性:己>戊 |