(本题共8分)在密闭容器中进行X2(气)+ 3Y2(气) 2Z(气)的反应,其X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),回答:
2Z(气)的反应,其X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),回答:
①各物质的浓度有可能的是 .
| A.c=0.5mol/L | B.b=0.5mol/L | C.c=0.4mol/L | D.a=0.3mol/L |
②若a= 时,b=0.15mol/L。
③a、b的取值必须满足的一般条件是 .
④a的取值范围是: .
( 13分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
| A |
|||||||||||||||||
| M |
Q |
R |
|||||||||||||||
| E |
D |
||||||||||||||||
| G |
J |
||||||||||||||||
请回答下列问题:
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的J原子有个。该晶体属于晶体
A .离子晶体 B . 原子晶体 C . 分子晶体 D. 金属晶体
(2)M3R2是一种直线型分子R=M=M=M=R,该分子是一种分子(填极性或非极性)。
(3)请写出D-的电子排布式:。
(4)M2A2也是直线型分子,1个分子中含有个σ键。
(5)化合物E2D6分子中各原子均达到了八电子稳定结构,请画出其结构式。(用元素符号表示)
为测定某石灰石中CaCO3的质量分数,称取W g石灰石样品,加入过量的浓度为6 mol/L的盐酸,使它完全溶解,加热煮沸,除去溶解的CO2,再加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀,离子方程式为:C2O2-4+Ca2+=CaC2O4↓,过滤出CaC2O4后,用稀硫酸溶解:CaC2O4+H2SO4=H2C2O4 +CaSO4,再用蒸馏水稀释溶液至V0 mL。取出V1 mL用a mol/L的KMnO4酸性溶液滴定,此时发生反应:
2MnO- 4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
若滴定终点时消耗a mol/L的KMnO4 V2 mL,计算样品中CaCO3的质量分数。
工业上制硫酸的主要反应如下:
4FeS2+11O2高温2Fe2O3+8SO2 2SO2+O2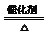 2SO3
2SO3
SO3+H2O=H2SO4。
用黄铁矿可以制取H2SO4,再用H2SO4可以制取化肥(NH4)2SO4。煅烧含 FeS2 80.0% 的黄铁矿 80.0 t,最终生产出 83.6 t (NH4)2SO4。已知 NH3的利用率为 92.6%,H2SO4的利用率为 95.0%,试求黄铁矿制取H2SO4时的损失率。
常温常压条件下,把30mL甲烷和氧气的混合气体点燃,冷却至常温,测得气体的体积为16mL,则原混合气体中甲烷和氧气的体积比?
在某硫酸铜溶液中,加入一个质量为1.12g的铁片,经过一段时间,铁片表面覆盖了一层红色的铜,取出洗净、烘干,称重,质量变为1.16g。计算在这个化学反应中溶解了铁多少克?