现有X(g)+Y(g) 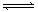 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的( )
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的( )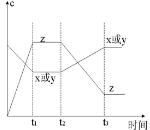
| A.增大X或Y的浓度 | B.增大压强 | C.增大Z的浓度 | D.升高温度 |
核潜艇上的核反应堆内使用了液体铝合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
| A.离子半径:Na+>Al3+ |
| B.铝钠合金若投入一定水中可得无色溶液并产生气泡 |
| C.若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越少 |
| D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知(1)a、d、e均能与稀盐酸反应产生氢气;(2)b能从c的盐溶液中置换出c单质;(3)a与强碱溶液反应放出气体;(4)a、e在冷浓硝酸或浓硫酸中发生钝化。由此可判断a、b、c、d、e依次是
| A.Fe、Cu、Ag、Al、Mg | B.Mg、Cu、Al、Ag、Fe |
| C.Al、Cu、Ag、Mg、Fe | D.Mg、Ag、Cu、Al、Fe |
下列离子或分子在溶液中能大量共存的是
| A.K+、CH3COOH、Br-、SiO32- | B.K+、Na+、Cl-、CO32- |
| C.Na+、Al3+、NH3·H2O、MnO4- | D.H+、Fe2+、SO42-、NO3- |
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是
| A.S2Cl2既作氧化剂又作还原剂 |
| B.H2O作还原剂 |
| C.每生成1 mol SO2转移4 mol电子 |
| D.氧化产物与还原产物物质的量之比为3∶1 |
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
| A.①③④ | B.①②⑤ | C.③④ | D.③④⑤ |