某无色透明溶液,能与铝作用放出氢气,此溶液中可以大量共存的离子组是( )
| A.H+、Mg2+、Cl-、Ba2+ | B.SO42-、Na+、HCO3-、K+ |
| C.NO3-、OH-、Cl-、Ba2+ | D.Cu2+、OH-、Fe2+、SO42- |
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:
2KClO3+H2C2O4+H2SO4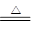 2ClO2↑+K2SO4+2CO2↑+2H2O,据此,下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,据此,下列说法不正确的是
| A.KClO3发生还原反应 |
| B.H2C2O4在反应中被氧化 |
| C.H2C2O4的氧化性强于ClO2的氧化性 |
| D.每1 mol ClO2生成,该反应转移的电子数约为6.02×1023 |
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将甲针筒内的物质压到乙针筒内,进行实验,对乙针筒里的现象所作的判断不正确的是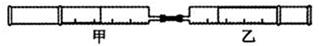
| 实验序号 |
甲针筒内物质 |
乙针筒内物质 |
乙针筒里的现象 |
| A |
HCl |
AgNO3溶液 |
产生白色沉淀 |
| B |
NH3 |
FeCl3溶液 |
出现红褐色沉淀 |
| C |
CO2 |
BaCl2 |
产生白色沉淀 |
| D |
Cl2 |
紫色石蕊溶液 |
先变红后褪色 |
下列化学反应对应的离子方程式书写正确的是
| A.醋酸溶液与Mg(OH) 2反应:Mg(OH) 2 +2H+ =Mg2+ +2H2O |
B.碳酸钠溶液呈碱性:CO32— +2H2O H2CO3 +2OH— H2CO3 +2OH— |
| C.NH4HCO3溶液与过量NaOH溶液反应:NH4+ +OH—=NH3·H2O |
D.用惰性电极电解饱和食盐溶液:2Cl—+2H2O 2OH— +Cl2↑+H2↑ 2OH— +Cl2↑+H2↑ |
下列关于有机物的表述正确的是
| A.油脂可水解生成丙三醇 |
| B.乙醇经还原可生成乙醛 |
| C.乙烯与苯均可使酸性高锰酸钾溶液褪色 |
| D.淀粉、蛋白质完全水解的产物互为同分异构体 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,8 g甲烷中含C-H键的数目为4NA |
| B.25℃时,1 L pH=13的Ba(OH) 2溶液中含有的OH—数为0.2NA |
| C.1 mol冰醋酸和1 mol乙醇经催化加热反应生成H2O分子数为NA |
| D.标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA |