下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是
| A.化合反应一定是氧化还原反应 | B.分解反应一定不是氧化还原反应 |
| C.置换反应一定是氧化还原反应 | D.复分解反应不一定是氧化还原反应 |
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:2SO2(g)+O2(g)  2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。
| 容器 |
甲 |
乙 |
| 反应物投入量 |
2 mol SO2、1 mol O2 |
4 mol SO3 |
| n(SO3)/mol |
1.6 |
a |
| 反应物的转化率 |
α1 |
α2 |
下列说法正确的是( )。
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率v(O2)=0.2 mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动
常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )。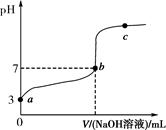
| A.a与b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| C.b点时,V(NaOH溶液)=20 mL,且c(CH3COO-)=c(Na+) |
D.a、b、c点表示的溶液中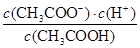 均相等 均相等 |
下列实验操作与预期目的或所得结论一致的是( )。
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 |
说明该钠盐是硫酸钠或硫酸氢钠 |
| B |
向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和Na2CO3溶液洗涤、分液 |
得到较纯净的乙酸乙酯 |
| C |
向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 |
说明汽油中含有甲苯等苯的同系物 |
| D |
向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 |
除去FeCl2溶液中的FeBr2 |
有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
下列叙述错误的是( )。
| A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O |
| B.1 mol Y发生类似酯化的反应,最多消耗2 mol X |
| C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 |
| D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强 |
下列说法正确的是( )。
A.反应A(g)  2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 |
| B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1 |
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终保持增大 始终保持增大 |