氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| C.3NO2+2H2O=3HNO3+NO |
| D.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
已知:298K时,2SO2(g) + O2(g)  2SO3(g);△H = —Q1 KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是
2SO3(g);△H = —Q1 KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是
| A.无法比较 | B.Q1<Q2 | C.Q1=Q2 | D.Q1>Q2 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的
| A.CaCO3(s) | B.Na2SO4溶液 |
| C.KNO3溶液 | D.CuSO4(s) |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+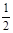 O2(g)=CO(g);△H=-393.5 kJ/mol O2(g)=CO(g);△H=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3 kJ |
| D.1/2 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol |
下列说法中正确的是
| A.非自发反应在任何条件下都不能实现 |
| B.自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
| C.凡是放热反应都是自发的,吸热反应都是非自发的 |
| D.熵增加且放热的反应一定是自发反应 |
升高温度时,化学反应速率加快,主要原因是
| A.分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.该化学反应的过程是吸热的 |
| D.该化学反应的过程是放热的 |