. 化学兴趣小组设定以下实验方案,测定某已部分变质为Na2CO3的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中需加热至恒重的目的是:
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)实验中判断沉淀是否完全的方法是
方案三:按如图装置进行实验:
(1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是
:
工业上常利用含硫废水生产海波Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。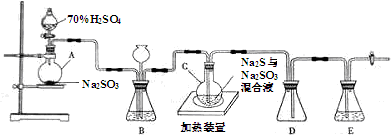
烧瓶C中发生反应如下:
Na2S+H2O+SO2=Na2SO3+H2S (Ⅰ)
2H2S+SO2=3S+2H2O (Ⅱ)
S+Na2SO3=Na2S2O3 (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaOH溶液
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂(稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
已知Na2S2O3·5H2O遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O
(5)为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液20mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出。
测得有关实验数据如下(标准状况):
| 第一份 |
第二份 |
第三份 |
|
| 样品的质量/g |
12.60 |
18.90 |
28.00 |
| 二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
所用硫酸溶液中溶质的物质的量浓度为 。
某校化学实验操作考试中,有一题目是鉴别澄清石灰水和氢氧化钠溶液。请你参与探究:
[提出问题]如何鉴别这两种无色溶液?
[实验方案]小琪等几位同学进行了下图所示的实验。
请你回答下列问题:
(1)C组实验中反应的化学方程式为 ;
(2)其中不能达到实验目的的是 (填字母);
(3)D组实验中变浑浊的原溶液是 。
[继续探究]实验结束后,小琪同学将A、B、C、D四组试管中的物质全部倒入同一个干净的烧杯中,充分反应后,得到无色澄清透明的溶液,对该溶液的成分又进行了探究。
[提出问题]该溶液中除水、酚酞外还含有哪些物质?
[查阅资料]氯化钙溶液呈中性。
[猜想与假设]Ⅰ.
Ⅱ.NaCl、 CaCl2、HCl
Ⅲ.NaCl、 CaCl2、NaOH
[反思与拓展]①上述猜想与假设中只有一个不成立,它是 (填序号),理由是 。
②根据所学化学知识,验证烧杯内溶液中可能有的物质是否存在,下列哪些物质单独使用不能完成该实验 (填字母)
a.pH试纸 b.硝酸银溶液 c.紫色石蕊试液 d.铜 e.足量氢氧化钠溶液
某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色.请看图回答问题:
(1)A中反应的化学方程式 ;B中白磷不燃烧,原因是
(2)D中看到的现象是 。
(3)用化学方程式表示E中颜色变化的原因 ;用F装置收集气体的依据是 。
用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: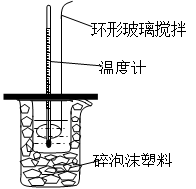
(1)烧杯中填满碎泡沫塑料的作用是 。
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替? (填“能”或“不能”),其原因是 。
(3)实验中若改用60mL0.50mol/L的盐酸与50 mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),若实验操作均正确,则所求中和热 (填“相等”或“不相等”)。
(4)已知在稀溶液中,强酸与强碱发生中和反应生成1molH2O,放出57.3kJ的热量,则上述反应的热化学方程式为
(5)实验中若改用60mL0.50mol/L的醋酸与50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“偏低”或“偏高”);原因是 。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
(1)步骤②加入过量H2O2的目的是 。
(2)步骤③中反应的离子方程式为 。
(3)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量。
(4)实验中用浓硫酸配制250mL1 mol/L的稀硫酸,配制时用到的玻璃仪器除了烧杯以外,还有 。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。