向下列溶液中滴加稀硫酸,生成白色沉淀,继续滴加稀硫酸,沉淀又消失的是
| A.Na2SiO3 | B.BaCl2 | C.FeCl3 | D.NaAlO2 |
日本福岛第一核电站泄漏出微量的钚(Pu)-239。下列关于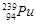 叙述准确的是
叙述准确的是
| A.原子序数是239 | B.质量数是94 | C.中子数是239 | D.质子数是94 |
下列气体只能用排水集气法收集的是
| A.NO | B.NO2 | C.SO2 | D.NH3 |
下列物质只含离子键的是
| A.H2O | B.Na2O | C.NaOH | D.HCl |
人们用DNA制造出一种臂长只有7nm的纳米镊子,这种镊子能钳起分子或原子,并对它随意组合。下列分散系中,分散质微粒直径与纳米粒具有相同数量级的是
| A.溶液 | B.胶体 | C.悬浊液 | D.乳浊液 |
配制500 mL 0.0500 mol·L-1的Na2CO3溶液,不需要的仪器有
| A.500 mL容量瓶 | B.锥形瓶 | C.烧杯 | D.玻璃棒 |