下列各组物质互为同分异构体的是
| A.O2和O3 | B.CH3CH2CH2CH3和CH(CH3)3 |
| C.12C和13C | D.CH3和CH3CH3 |
下列变化过程,需要加入氧化剂的是
| A.HCl→MgCl2 | B.Na+→Na | C.CO→CO2 | D.Fe3+→Fe2+ |
下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
| A.SO3+H2O===H2SO4 |
| B.3NO2+H2O===2HNO3+NO |
| C.2F2+2H2O===4HF+O2 |
| D.2Na+2H2O===2NaOH+H2↑ |
下面有关氧化还原反应的叙述正确的是
| A.有单质参加或生成的反应不一定是氧化还原反应 |
| B.肯定有一种元素被氧化,另一种元素被还原 |
| C.非金属单质在反应中只作氧化剂 |
| D.某元素从化合态变为游离态时,该元素一定被还原 |
高铁酸钾(KFeO4)是一种新型、高效、多功能水处理剂。下列反应可制取KFeO4:2Fe(OH)3+3Cl2+10KOH 2KFeO4+6KCl+8H2O,对于该反应下列说法正确的是
2KFeO4+6KCl+8H2O,对于该反应下列说法正确的是
| A.该反应是置换反应 | B.钾元素化合价降低 |
| C.Fe(OH)3发生还原反应 | D.Cl2是氧化剂 |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是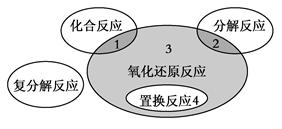
| A.4Fe(OH)2+O2+2H2O===4Fe(OH)3 |
B.2NaHCO3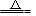 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
C.4NH3+5O2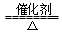 4NO+6H2O 4NO+6H2O |
| D.Zn+H2SO4===ZnSO4+H2↑ |